题目内容
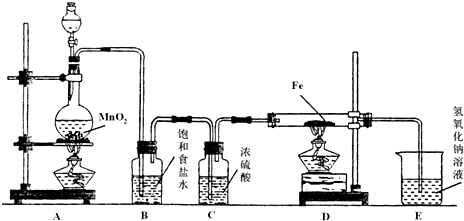
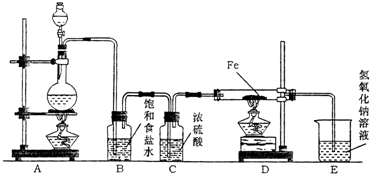 某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.
某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.(1)装置A烧瓶中发生反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(2)装置B中饱和食盐水的作用是
除去HCl
除去HCl
,装置C中浓硫酸的作用是吸收水蒸气
吸收水蒸气
;(3)实验时,先点燃
A
A
处的酒精灯,再点燃D
D
处酒精灯,写出D中反应的化学方程式2Fe+3Cl2=2FeCl3
2Fe+3Cl2=2FeCl3
,写出E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
;(4)若实验中用12mol?L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:①
HCl挥发
HCl挥发
,②浓盐酸变稀不再反应
浓盐酸变稀不再反应
.欲使反应生成Cl2的物质的量最大程度的接近0.03mol,则在装置气密性良好的前提下实验中应采取的措施是
慢慢滴加浓盐酸,缓缓加热
慢慢滴加浓盐酸,缓缓加热
.分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应;
(2)根据氯化氢和氯气的性质分析选用除杂试剂;浓硫酸常常干燥能和碱反应气体;
(3)先生成氯气充满装置后再加热D处铁和氯气发生反应,氯气有强氧化性,能把二价铁离子氧化为三价铁离子,尾气吸收需要用氢氧化钠溶液吸收氯气;
(4)反应过程中浓盐酸是易挥发性酸,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气;反应过程中尽可能减少反应为损失,缓慢加热减少氯化氢的挥发;
(2)根据氯化氢和氯气的性质分析选用除杂试剂;浓硫酸常常干燥能和碱反应气体;
(3)先生成氯气充满装置后再加热D处铁和氯气发生反应,氯气有强氧化性,能把二价铁离子氧化为三价铁离子,尾气吸收需要用氢氧化钠溶液吸收氯气;
(4)反应过程中浓盐酸是易挥发性酸,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气;反应过程中尽可能减少反应为损失,缓慢加热减少氯化氢的挥发;
解答:解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
,注意稀盐酸和二氧化锰不反应.
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应饱和食盐水;浓硫酸常常干燥能和碱反应气体,故选浓硫酸.
故答案为:除去HCl; 吸收水蒸气;
(3)实验开始需要先生成氯气充满装置后,再加热D处铁和氯气发生反应,氯气有强氧化性,能把二价铁离子氧化为三价铁离子,反应的离子方程式为:2Fe+3Cl2=2FeCl3;尾气吸收需要用氢氧化钠溶液吸收氯气,反应的离子方程式为,Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:A; D;2Fe+3Cl2=2FeCl3; Cl2+2OH-=Cl-+ClO-+H2O;
(4)反应过程中浓盐酸是易挥发性酸,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气;若实验中用12mol?L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,原因是HCl挥发,浓盐酸变稀不再反应;欲使反应生成Cl2的物质的量最大程度的接近0.03mol,反应过程中尽可能减少反应为损失,缓慢加热减少氯化氢的挥发;
故答案为:HCl挥发,浓盐酸变稀不再反应;慢慢滴加浓盐酸,缓缓加热;
| ||
,注意稀盐酸和二氧化锰不反应.
故答案为:MnO2+4HCl(浓)
| ||
(2)制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应饱和食盐水;浓硫酸常常干燥能和碱反应气体,故选浓硫酸.
故答案为:除去HCl; 吸收水蒸气;
(3)实验开始需要先生成氯气充满装置后,再加热D处铁和氯气发生反应,氯气有强氧化性,能把二价铁离子氧化为三价铁离子,反应的离子方程式为:2Fe+3Cl2=2FeCl3;尾气吸收需要用氢氧化钠溶液吸收氯气,反应的离子方程式为,Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:A; D;2Fe+3Cl2=2FeCl3; Cl2+2OH-=Cl-+ClO-+H2O;
(4)反应过程中浓盐酸是易挥发性酸,随反应进行盐酸浓度减小,稀盐酸和二氧化锰不能生成氯气;若实验中用12mol?L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,原因是HCl挥发,浓盐酸变稀不再反应;欲使反应生成Cl2的物质的量最大程度的接近0.03mol,反应过程中尽可能减少反应为损失,缓慢加热减少氯化氢的挥发;
故答案为:HCl挥发,浓盐酸变稀不再反应;慢慢滴加浓盐酸,缓缓加热;
点评:本题考查了氯气的实验室制法及化学性质,难度不大,氯气的氧化性、二价铁离子和三价铁离子的检验是高考的热点,注意方向反应过程的量的变化,题目难度中等.

练习册系列答案
相关题目