题目内容
下列除去杂质的实验方法正确的是
- A.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
- B.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
- C.除去乙烷中混有的少量乙烯:在一定条件下加入适量氢气充分反应
- D.除去蛋白质溶液中混入的少量氯化钠:加入AgNO3溶液后过滤
分析:根据除杂的基本原则“不减、不增、不污、易分”来分析.也就是,除去杂质的同时,要保证不能使所需物质的量减少,但可以增加,更不能引入新的杂质,生成物还不能造成环境污染,并且,生成物、所选试剂与所需物质要容易分离.
A.加热不能除掉钠离子;
B.双氧水能将二价体氧化为三价铁;
C.过量的氢气引入了新的杂质;
D.AgNO3溶液是重金属盐能使蛋白质发生变性.
解答:A.利用碳酸氢钠受热易分解的性质,可将其转换为碳酸钠,碳酸钠仍为杂质,故A错误;
B.稍过量双氧水能将二价体氧化为三价铁,故可除去FeCl3酸性溶液中少量的FeCl2,故B正确;
C.将混合气体在一定条件下加入适量氢气充分反应会使乙烯成为乙烷,但氢气的量无法控制,过量的氢气也是杂质,故达不到除杂目的,故C错误;
D.AgNO3溶液是重金属盐能使蛋白质发生变性,故D错误.
故选B.
点评:本题考查物质的分离、提纯和除杂,解答此类题型不但要明确除杂的基本原则“不减、不增、不污、易分”,而且对课本上常见的物质的性质必须熟悉.

A.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4![]() HBr+NaHSO4 ①
HBr+NaHSO4 ①
R-OH+HBr![]() R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
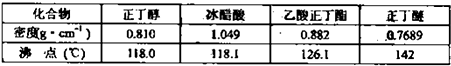
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”);其原因是
。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,起目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
已知:
|
药品名称 |
熔点/℃ |
沸点(℃) |
密度g/cm3 |
溶解性 |
|
正丁醇 |
-89.5 |
117.7 |
0.8098 |
微溶于水、溶于浓硫酸 |
|
1-溴丁烷 |
-112.4 |
101.6 |
1.2760 |
不溶于水和浓硫酸 |
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品在如图装置的圆底烧瓶中依次加入NaBr,10 mL 正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。

(1)写出制备1-溴丁烷的化学反应方程式:__________________________________________________
(2)反应装置中加入沸石的目的是__________________。配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3)反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图装置蒸馏。

(5)收集产品时,控制的温度应在_________℃左右;区分1-溴丁烷精品和粗品的一种方法是____________________。
(6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。
(12分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4 HBr+NaHSO4 ①
R-OH+HBr
HBr+NaHSO4 ①
R-OH+HBr R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
|
|
乙醇 |
溴乙烷 |
正丁醇 |
1-溴丁烷 |
|
密度/g·cm-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
|
沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:[来源:学。科。网]
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是 。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d. KCl
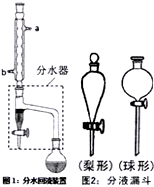 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式: