题目内容
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+![]() O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+![]() O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g)![]() CH3OH(g)ΔH=___。
CH3OH(g)ΔH=___。
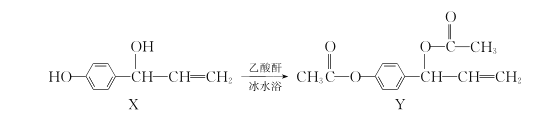
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____。
②X轴上b点的数值比a点___(填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是___。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=___;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)![]() PbCl2(s)+2I-(aq)的平衡常数K=___。
PbCl2(s)+2I-(aq)的平衡常数K=___。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
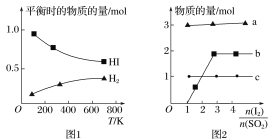
①反应H2(g)+I2(g)![]() 2HI(g)的ΔH__(填大于或小于)0。
2HI(g)的ΔH__(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
【答案】-129kJ/mol 25% 大 该反应为放热反应,随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)向逆反应方向进行,故Y为温度 4×10-9 2.5×10-4 小于 H+ I3- 减小
CH3OH(g)向逆反应方向进行,故Y为温度 4×10-9 2.5×10-4 小于 H+ I3- 减小![]() 的投料比
的投料比
【解析】
(1)①CO(g)+![]() O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+![]() O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
将①+②×2-③得:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-129kJ/mol。
CH3OH(g) ΔH=-129kJ/mol。
答案为:-129kJ/mol;
(2)①平衡时,M点CH3OH的体积分数为10%,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 1mol 2mol 0
变化量 x 2x x
平衡量 1-x 2-2x x
![]() x=0.25mol
x=0.25mol
则CO的转化率为![]() 。
。
答案为:25%;
②因为随着X的增大,甲醇的体积分数增大,说明平衡正向移动,X轴应表示压强。
X轴上b点的数值比a点大。答案为:大;
某同学认为图中Y轴表示温度,他判断的理由是:该反应为放热反应,随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)向逆反应方向进行,故Y为温度。
CH3OH(g)向逆反应方向进行,故Y为温度。
答案为:该反应为放热反应,随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)向逆反应方向进行,故Y为温度;
CH3OH(g)向逆反应方向进行,故Y为温度;
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=![]() 。
。
答案为:4×10-9;
已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)![]() PbCl2(s)+2I-(aq)的衡常数K=
PbCl2(s)+2I-(aq)的衡常数K=![]() 。答案为:2.5×10-4;
。答案为:2.5×10-4;
(4)①因为随着温度的不断升高,HI的物质的量不断减小,所以平衡逆向移动,正反应为放热反应。反应H2(g)+I2(g)![]() 2HI(g)的ΔH小于0。答案为:小于;
2HI(g)的ΔH小于0。答案为:小于;
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,
3H++HSO4-+2I-,
I2+I-![]() I3-;
I3-;
令投入的SO2为1mol,从反应方程式可以看出,H+的物质的量是SO2的三倍,I-的物质的量是SO2的二倍,再结合图2,即可得出图2中曲线a代表的微粒是H+。答案为:H+;
B代表的微粒是I3-。答案为:I3-;
由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是增大SO2的投入量,同时减少I2的投入量,即减小![]() 的投料比。
的投料比。
答案为:减小![]() 的投料比。
的投料比。

【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是__。
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是__。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)本实验所得到的环己烯产率是__(填正确答案标号)。
A.41% B.50% C.61% D.70%
【题目】某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
褪色时间/s | 116 | 6 | 117 |
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。


【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。

(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH B.FeS C.Na2S