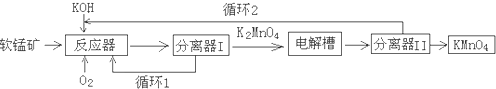
题目内容
12.下列说法中,正确的是( )| A. | 将某种稀酸溶液,用蒸馏水稀释10倍,其pH一定增大一个单位 | |
| B. | 100℃时的NaCl溶液,PH约为6时呈中性. | |
| C. | pH相同的醋酸和H2SO4分别能恰好中和等物质的量的NaOH | |
| D. | 将0.1mol/L CH3COOH溶液加水稀释10倍,溶液中所有离子的浓度均减小 |
分析 A.根据强电解质的电离,弱电解质的电离平衡来分析稀释后的pH;
B.100℃时,KW=1×10-12,溶液的酸碱性取决于C(H+)和C(OH-)的相对大小,如果C(H+)=C(OH-)时,溶液呈中性;
C.pH相同的醋酸和H2SO4溶液,溶质的物质的量不同;
D.加水稀释后,溶液中氢氧根离子浓度增大.
解答 解:A.根据酸溶液的稀释定律:若pH=a的强酸,加水稀释至原来体积的10倍,则pH=a+1(a+1<7,若a+1=7,则稀释后的pH≈7);若酸是弱酸,稀释时促进电离,所以将pH=a的溶液稀释10倍后,则pH变大,但PH<a+1,所以将某种稀酸溶液,用蒸馏水稀释10倍,稀释后PH≤a+1,故A错误;
B.100℃时,KW=1×10-12,100℃时的NaCl溶液,PH约为6,C(H+)=1×10-6,C(OH-)=$\frac{1×1{0}^{-12}}{1×1{0}^{-6}}$=10-6 mol/L,C(H+)=C(OH-)溶液呈中性,故B正确;
C.pH相同的醋酸和H2SO4溶液中氢离子浓度相同,由于醋酸是弱酸,部分电离,所以醋酸的浓度大,而且醋酸和H2SO4溶液的体积未知,所以当体积相同时,醋酸的物质的量多,所以醋酸中和的氢氧化钠多,故C错误;
D.醋酸是弱电解质,存在电离平衡,CH3COOH?CH3COO-+H+,加水稀释10倍,溶液中的c(H+)减小,KW=C(H+)×C(OH-),同一温度下,KW不变,溶液中氢氧根离子浓度增大,故D错误;
故选B.
点评 本题考查了溶液的酸碱性与离子积常数等知识,注意溶液的酸碱性取决于C(H+)和C(OH-)的相对大小,不取决于溶液pH的大小,为易错点,题目难度不大.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
2.在如图所示的装置中,a的金属活动性排在氢之前,b为碳棒,关于此装置的各种叙述正确的是( )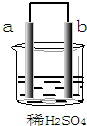

| A. | b极上发生了还原反应 | |
| B. | a是正极,b是负极 | |
| C. | a极上放出气体,溶液的pH增大 | |
| D. | 导线中有电子流动,电子从b极流到a极 |
3.下列电子层中,不包含有p能级的是( )
| A. | K电子层 | B. | L电子层 | C. | M电子层 | D. | N电子层 |
7.银锌电池是广泛用做各种电子仪器的电源,其放电过程可表示为Ag2O+Zn=ZnO+2Ag,此电池放电时,有关说法正确的是( )
| A. | 电能转化为化学能 | B. | 电解质溶液是稀硫酸 | ||
| C. | 电子通过外电路从正极流向负极 | D. | Zn做负极被氧化 |
17.下列说法正确的是( )
| A. | F是最活泼非金属,Li是最活泼金属 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | NaOH易溶于水,Ca(OH)2微溶,所以NaOH碱性比Ca(OH)2强 |

 ;
;