题目内容
下列有关图象的分析正确的是( )
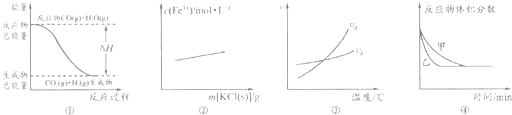

| A、图①表示反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H大于0 | B、图②可表示反应“3KSCN+FeCl3?Fe(SCN)3+3KCl”向正反应方向移动 | C、图③表示反应“A2(g)+3B2(g)?3AB3(g)”的△H小于0 | D、图④可表示压强对反应‘‘2A(g)+2B(g)?3C(g)+D(s)”的影响,且乙的压强大 |
分析:A、依据图象分析可知反应物的能量高于生成物,反应是放热反应,焓变小于0;
B、氯化钾对平衡无影响;
C、图象分析,随温度升高,逆反应速率大于正反应速率,平衡逆向进行;
D、反应中D为固体,分析反应前后气体体积减小,增大压强平衡正向进行.
B、氯化钾对平衡无影响;
C、图象分析,随温度升高,逆反应速率大于正反应速率,平衡逆向进行;
D、反应中D为固体,分析反应前后气体体积减小,增大压强平衡正向进行.
解答:A、依据图象分析可知反应物的能量高于生成物,反应是放热反应,焓变小于0,△H<0,故A错误;
B、反应“3KSCN+FeCl3?Fe(SCN)3+3KCl”离子方程式为Fe3++3SCN-=Fe(SCN)3,氯化钾对平衡无影响,故B错误;
C、图象分析,随温度升高,逆反应速率大于正反应速率,平衡逆向进行,△H小于0,故C正确;
D、反应中D为固体,分析反应前后气体体积减小,增大压强平衡正向进行,平衡状态下反应为体积分数分数变化,故D错误;
故选C.
B、反应“3KSCN+FeCl3?Fe(SCN)3+3KCl”离子方程式为Fe3++3SCN-=Fe(SCN)3,氯化钾对平衡无影响,故B错误;
C、图象分析,随温度升高,逆反应速率大于正反应速率,平衡逆向进行,△H小于0,故C正确;
D、反应中D为固体,分析反应前后气体体积减小,增大压强平衡正向进行,平衡状态下反应为体积分数分数变化,故D错误;
故选C.
点评:本题考查了化学反应的焓变分析,化学平衡影响因素分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式.下表列举了不同温度下大气固氮和工业固氮的部分K值(K表示平衡常数):
| N2+O2?2NO | N2+3H2?2NH3 | |||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| K | 3.84×10-31 | 0.1 | 5×108 | 200 |
(1)固氮是指______的过程,自然界固氮的另一途径为______.
(2)根据表中的数据,并结合所学知识分析,下列说法正确的是______.
a.人类大规模模拟大气固氮实际意义很小
b.常温下,大气固氮与工业固氮完成程度相差很大
c.两种固氮都是放热反应 d.在常温下,大气固氮几乎不可能,而工业固氮很容易进行
(3)为研究反应条件的改变对化学平衡移动的影响,将N2和H2在一固定体积的密闭容器中进行反应,得到如下的图象.下列有关条件改变(每次只改变一个条件)的说法,正确的是______.
a.t2可能是增加了原料的物质的量
b.t4可能是充入了He气
c.t5是从反应体系中分离出氨气
d.t7时可能是升高温度,使平衡向正反应方向移动
(4)目前工业固氮采用的是哈伯法,即在20~50MPa的高压和500℃左右的高温下,并用铁触媒作为催化剂.俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2+3H2?2NH3.有关说法正确的是______.
a.新法不需要高温条件,可节约大量能源
b.新法能在常温下进行是因为不需要断裂化学键
c.在相同温度下不同的催化剂其催化活性不同.
