题目内容
以下各条件的改变可确认发生了化学平衡移动的是 ( )
| A.化学反应速率发生了改变 |
| B.有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
| D.可逆反应达到平衡后,加入了催化剂 |
C
解析试题分析:A.化学反应速率发生了改变,平衡不一定发生移动。如加入催化剂速率改变,但平衡没有移动。错误。B.有气态物质参加的可逆反应若是反应前后气体体积相等,达到平衡后,通过改变容器的容积来改变了压强,则化学平衡不发生移动。C.当可能反应达到平衡状态时每个组分的浓度、平衡时的含量都保持不变。如果某成分的含量或浓度发生了改变,则平衡一定发生了改变,即发生了移动。正确。D.可逆反应达到平衡后,加入了催化剂对化学平衡的移动无影响。错误。
考点:考查使化学平衡发生移动的影响因素的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NO2存在下列平衡:2NO2(g)  N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
| A.温度130℃、压强3.03×105 Pa | B.温度25℃、压强1.01×105 Pa |
| C.温度130℃、压强5.05×104 Pa | D.温度0℃、压强5.05×104 Pa |
某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH > 0,
Z(g)+W(s) ΔH > 0,
下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体密度不变时,反应达到平衡 |
| C.升高温度,Y的百分含量减少 |
| D.平衡后加入X,上述反应的ΔH增大 |
下列事实中,能用勒沙特列原理来解释的是
| A.由H2(g)、I2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 |
| B.久置的氯水变成了稀盐酸 |
| C.在FeCl3溶液中加入铁粉防止氧化变质 |
| D.加入催化剂有利于SO2与O2反应制SO3 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)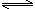 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
恒温、恒容的条件下对于N2(g)+3H2(g) 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
| A.断开一个N≡N键的同时有6个N—H键生成 |
| B.混合气体的密度不变 |
| C.混合气体的压强不变 |
| D.N2、H2、NH3分子数之比为1:3 :2的状态 |
对于在一定条件下进行的化学反应:2SO2 + O2  2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3 ,改变下列条件,可以提高反应物中的活化分子百分数的是
| A.降低温度 | B.增大压强 | C.使用催化剂 | D.增大反应物浓度 |
 2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的 )
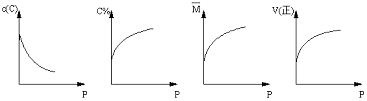
) xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是