题目内容
.(12分)由等物质的量的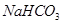 和
和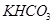 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中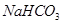 与
与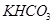 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 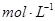 。
。
(3)如果盐酸过量,生成 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成 的体积,还需要知道 。
的体积,还需要知道 。
(5)若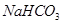 和
和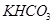 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成 的物质的量(用n表示)的范围是
。
的物质的量(用n表示)的范围是
。
(12分,每空2分)(1)8.4 g 10 g (2)2 (3)4.48
(4)盐酸的物质的量浓度(或其他合理答案) (5)0.184<n<0.219
【解析】(1)设二者的物质的量都是x,则84x+100x=18.400,解得x=0.1mol,所以混合物中 与
与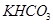 的质量分别为8.4g和10.0g。
的质量分别为8.4g和10.0g。
(2)碳酸氢盐与盐酸的方程式为H++HCO3-=H2O+CO2↑,所以消耗的盐酸是0.2mol,浓度是2.0mol/L。
(3)根据碳原子守恒可知,生成的CO2是0.2mol,标准状况下的体积是4.48L。
(4)如果盐酸不足,则要计算生成的CO2体积,还需要知道盐酸的浓度。
(5)可以采用极值法。如果全部是碳酸氢钠,则生成CO2是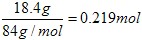 ;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。
;如果全部是碳酸氢钾,则生成CO2是18.4÷100=0.184mol,即CO2的范围是0.184<n<0.219。

 阅读快车系列答案
阅读快车系列答案(12分)某研究性小组进行如下实验:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?__________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____ 0.2mol/L(填﹥、﹤或=)。混合液中离子浓度c(A-) c(Na+)(填﹥、﹤或=)。
(3)从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是_____ ___。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
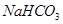 和
和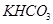 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)  。
。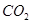 的体积为 L。
的体积为 L。