题目内容
13.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 100mL 1mol•L-1FeCl3溶液中含阳离子数为0.1NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA | |
| C. | 0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA | |
| D. | 80Ml 10mol•L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
分析 A、Fe3+是弱碱阳离子,在溶液中会水解;
B、乙醛在标准状况下是液体;
C、CaCO3与KHCO3的摩尔质量均为100g/mol;
D、依据浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应进行解答.
解答 解:A、Fe3+是弱碱阳离子,在溶液中会水解:Fe3++3H2O?Fe(OH)3+3H+,导致阳离子的个数增多,故溶液中含有的阳离子的个数多于0.1NA个,故A错误;
B、乙醛在标准状况下是液体,2.24L乙醛的物质的量不是0.1mol,故B错误;
C、CaCO3与KHCO3的摩尔质量均为100g/mol,故0.6g混合物的物质的量为0.006mol,而1molCaCO3与KHCO3中均含50mol质子,故0.006mol混合物中含0.3NA个质子,故C正确;
D、80 mL 10mol•L-1浓盐酸含0.8molHCl,浓盐酸与足量MnO2混合加热,随着反应进行浓盐酸浓度变稀后不再与二氧化锰进行反应,所以0.8mol HCl不能全部反应,故转移电子数不是0.4NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
1.如图是制取和收集某气体的实验装置,可用于( )
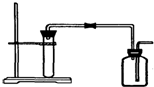

| A. | 用Zn粒与稀HCl反应制H2 | B. | 用大理石与稀HCl反应制CO2 | ||
| C. | 用Cu与稀HNO3反应制NO | D. | 用MnO2与浓HCl反应制Cl2 |
5.下列关于氯水的叙述中,正确的是( )
| A. | 久置的氯水中已没有分子,只有离子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴入酚酞试液显红色的溶液中:K+、Na+、Cu2+、SO42- | |
| B. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Ba2+、Cl-、ClO- | |
| C. | 水电离产生的c(H+)=10-13mol•L-1 的溶液中:Na+、Cl-、NO3-、CH3COO- | |
| D. | pH=0的溶液中:Na+、NO3-、S2-、Cl- |
3.下列各组溶液,不用其它试剂,无法将它们区别开的是( )
| A. | HCl、CuSO4、Mg(NO3)2、KOH | B. | NaBr、AgNO3、HCl、Na2CO3 | ||
| C. | H2SO4、NaCl、Na2SO4、Na2CO3 | D. | NaOH、(NH4)2CO3、Na2CO3、KHSO4 |