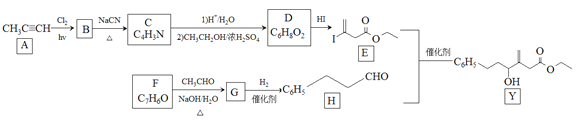
题目内容
【题目】2018年4月,美国公布301征税建议清单,对包括铜、锌等贱金属及其制品在内的1300种中国商品加征高达25%的关税,请回答下列有关锌、铜及其化合物的问题:
(1)写出基态Zn原子的外围电子排布式__________________。
(2)新型农药松脂酸铜具有低残留的特点,下图1是松脂酸铜的结构简式:

松脂酸铜结构中π键的个数为___________;加“*”碳原子的杂化方式为________________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是________________________________。
(4)工业上在用黄铜矿冶炼铜时会产生副品SO2,SO2分子的几何构型为____________,比较第一电离能:S__________O(填“>”“=”或“<”)
(5)ZnS的晶胞结构如下图2所示,在ZnS晶胞中,与每个Zn2+最近且等距离的Zn2+有______个。
(6)铜与金形成的金属互化物结构如下图3,晶胞边长为anm,该金属互化物的密度为__________ g·cm-3(用含“a、NA的代数式”表示)。

【答案】 3d104s2 6 sp3 异硫氰酸分子间可形成氢键,而硫氰酸不能 折线形(V形或角形) < 12 ![]()
【解析】(1)Zn原子核外电子数为30,根据能量最低原理书写外围电子排布式;
(2)单键为σ键,双键含有1个σ键、1个π键;加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(3)异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键
(4)SO2分子中S原子孤对电子数为![]() =1、价层电子对数=2+1=3,同主族自上而下第一电离能减小.
=1、价层电子对数=2+1=3,同主族自上而下第一电离能减小.
(5)与每个Zn2+最近且等距离的Zn2+分布在立方体的面心上,每个Zn2+被8个立方体共用,有12个面与之相连.
(6)根据均摊法计算出晶胞中Cu、Au原子数,根据ρ=![]() 计算密度.
计算密度.
(1) Zn原子核外电子数为30,根据能量最低原理,外围电子排布式为:3d104s2;答案为:3d104s2
(2)1个松脂酸铜中含有6个双键,则含有6个π键,加“”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化,故答案为:6;sp3
(3)由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,故答案为:异硫氰酸分子间可形成氢键,而硫氰酸不能
(4)S原子孤对电子数为![]() =1、价层电子对数=2+1=3,故其空间结构为折线形(V形或角形),同主族自上而下第一电离能减小,则第一电离能S<O,故答案为:折线形(V形或角形);<.
=1、价层电子对数=2+1=3,故其空间结构为折线形(V形或角形),同主族自上而下第一电离能减小,则第一电离能S<O,故答案为:折线形(V形或角形);<.
(5)根据晶胞的结构可知,以晶胞中顶点上的Zn2+为研究对象,与它距离最近等距离的Zn2+分布在立方体的面心上,每个Zn2+被8个立方体共用,有12个面与之相连,所以每个Zn2+周围与它距离最近等距离的Zn2+有12个,答案为:12
(6)Cu原子位于晶胞面心,数目为6×![]() =3,Au原子为晶胞顶点,数目为8×
=3,Au原子为晶胞顶点,数目为8×![]()
=1,晶胞体积V=(a×10-7)3,密度ρ=![]() =
= ![]() ,答案为:
,答案为:![]()