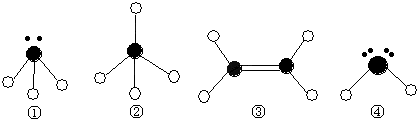
题目内容
A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).

请回答下列问题:
(1)D的化学式为______、Y的化学式为______、E的化学式为______.
(2)反应③的离子方程式为______.
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为______.
(4)0.1mol?L-1的X溶液和0.1mol?L-1的Y溶液等体积混合,溶液呈______性(填“酸”、“碱”或“中”),原因是______(用离子方程式说明).
解:本框图突破口之一是“白烟”,是挥发性酸和氨气相遇后的产物,由此可推知D是H2,突破口之二是“红棕色气体”,F应为NO2,反推可知E为NO,C为O2,Z为H2O,Y为NH3,X为HCl,G为HNO3,则A为Cl2,B为N2,
(1)由以上分析可知D为H2,Y为NH3,E为NO,故答案为:H2;NH3;NO;
(2)③为NO2与H2O的反应,反应的离子方程式为3NO2+H2O=2H++2NO3-+NO,
故答案为:3NO2+H2O=2H++2NO3-+NO;
(3)E为NO,为污染性气体,在一定条件下可与NH3反应生成N2和H2O,反应的化学方程式为4NH3+6NO=5N2+6H2O,
故答案为:4NH3+6NO=5N2+6H2O;
(4)两者恰好完全反应时生成NH4Cl,为强酸弱碱盐,溶液中存在NH4++H2O?NH3?H2O+H+,铵根离子水解而使溶液显酸性,
故答案为:酸;NH4++H2O?NH3?H2O+H+.
分析:本框图突破口之一是“白烟”,是挥发性酸和氨气相遇后的产物,由此可推知D是H2,突破口之二是“红棕色气体”,F应为NO2,反推可知E为NO,C为O2,Z为H2O,Y为NH3,X为HCl,G为HNO3,则A为Cl2,B为N2,以此结合物质的性质可解答该题.
点评:本题考查物质的推断,题目难度中等,本题注意从物质反应的典型现象作为该题的突破口,该题中注意把握盐类的水解以及弱电解质的电离.
(1)由以上分析可知D为H2,Y为NH3,E为NO,故答案为:H2;NH3;NO;
(2)③为NO2与H2O的反应,反应的离子方程式为3NO2+H2O=2H++2NO3-+NO,
故答案为:3NO2+H2O=2H++2NO3-+NO;
(3)E为NO,为污染性气体,在一定条件下可与NH3反应生成N2和H2O,反应的化学方程式为4NH3+6NO=5N2+6H2O,
故答案为:4NH3+6NO=5N2+6H2O;
(4)两者恰好完全反应时生成NH4Cl,为强酸弱碱盐,溶液中存在NH4++H2O?NH3?H2O+H+,铵根离子水解而使溶液显酸性,
故答案为:酸;NH4++H2O?NH3?H2O+H+.
分析:本框图突破口之一是“白烟”,是挥发性酸和氨气相遇后的产物,由此可推知D是H2,突破口之二是“红棕色气体”,F应为NO2,反推可知E为NO,C为O2,Z为H2O,Y为NH3,X为HCl,G为HNO3,则A为Cl2,B为N2,以此结合物质的性质可解答该题.
点评:本题考查物质的推断,题目难度中等,本题注意从物质反应的典型现象作为该题的突破口,该题中注意把握盐类的水解以及弱电解质的电离.

练习册系列答案
相关题目
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
形
(2)某同学根据上述信息,所画的B电子排布图如图

违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
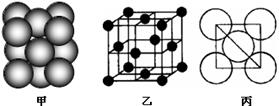
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
⑵某同学根据上述信息,所画的B电子排布图如图
 ,违背了 原理。
,违背了 原理。⑶F位于 族 区,其基态原子有 种运动状态。
⑷CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 ,检验E元素的方法是 。
⑸若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。

【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素原子的核外p电子总数比s电子总数少1 |
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
|
C原子核外所有p轨道全满或半满 |
|
D元素的主族序数与周期数的差为4 |
|
E是前四周期中电负性最小的元素 |
|
F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .