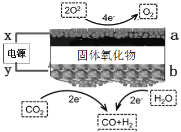
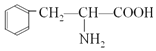题目内容
【题目】常温下,用![]() 溶液分别滴定
溶液分别滴定![]() 溶液和
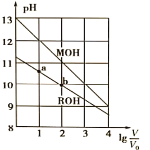
溶液和![]() 溶液,得到2条滴定曲线,如下图所示:
溶液,得到2条滴定曲线,如下图所示:
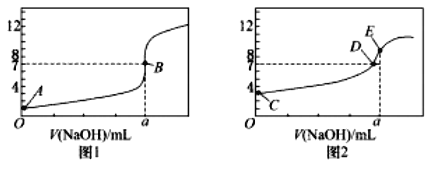
![]() 由A、C点判断,滴定HCl溶液的曲线是_____
由A、C点判断,滴定HCl溶液的曲线是_____![]() 填“图1”或“图2”
填“图1”或“图2”![]() ;
;
![]()
![]() ____
____![]() ;
;
![]()
![]() 的点是_________;
的点是_________;
![]() 点对应离子浓度由大到小的顺序为___________________________。
点对应离子浓度由大到小的顺序为___________________________。
![]() 当NaOH溶液滴定
当NaOH溶液滴定![]() 溶液过程中,NaOH溶液消耗了
溶液过程中,NaOH溶液消耗了![]() mL时,则此时混合液中
mL时,则此时混合液中![]() ____c
____c![]() “
“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 室温时,浓度均为
室温时,浓度均为![]() 的
的![]() 和NaOH的混合液
和NaOH的混合液![]() ,则溶液中
,则溶液中![]() ___________
___________![]()
【答案】图1 ![]()
![]()
![]()
![]()
![]()
【解析】
![]() 由于盐酸为强酸、醋酸为弱酸,故等浓度的盐酸和醋酸的pH前者小,所以滴定HCl溶液的曲线是图1;
由于盐酸为强酸、醋酸为弱酸,故等浓度的盐酸和醋酸的pH前者小,所以滴定HCl溶液的曲线是图1;
![]() 根据图1和图2分析可知当横坐标为a时,盐酸、醋酸分别和氢氧化钠溶液恰好反应完全,故
根据图1和图2分析可知当横坐标为a时,盐酸、醋酸分别和氢氧化钠溶液恰好反应完全,故![]() ;
;
![]() 根据电荷守恒可知图2中
根据电荷守恒可知图2中![]()
![]() 的点呈中性,因此对应的点为D点;
的点呈中性,因此对应的点为D点;
![]() 点的溶液为醋酸钠溶液,由于醋酸根离子水解溶液呈碱性,因此离子浓度关系为:
点的溶液为醋酸钠溶液,由于醋酸根离子水解溶液呈碱性,因此离子浓度关系为:![]() ;
;
![]() 当NaOH 溶液滴定
当NaOH 溶液滴定![]() 溶液过程中,NaOH溶液消耗了
溶液过程中,NaOH溶液消耗了![]() mL时,所得溶液为等浓度的醋酸和醋酸钠的混合溶液,根据图像可知溶液呈酸性,即醋酸的电离大于醋酸根的水解,因此
mL时,所得溶液为等浓度的醋酸和醋酸钠的混合溶液,根据图像可知溶液呈酸性,即醋酸的电离大于醋酸根的水解,因此![]() 小于c
小于c ![]() ;
;
![]() 溶液中存在电荷守恒
溶液中存在电荷守恒![]() 以及物料守恒
以及物料守恒![]() ,所以
,所以![]()
![]() 。
。

【题目】如表是不同温度下水的离子积数据:
温度 | 25 |
|
|
水的离子积常数 |
|
|
|
试回答以下问题:
![]() 若
若![]() ,则
,则![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,作出此判断的理由是__________。
,作出此判断的理由是__________。
![]() 下,某
下,某![]() 溶液中
溶液中![]() ,取该溶液
,取该溶液![]() ,加水稀释至
,加水稀释至![]() ,则稀释后溶液中
,则稀释后溶液中![]() span>__________。
span>__________。
![]() 下,将
下,将![]() 的苛性钠溶液
的苛性钠溶液![]() 与
与![]() 的稀硫酸
的稀硫酸![]() 混合
混合![]() 设混合后溶液的体积为原两溶液体积之和
设混合后溶液的体积为原两溶液体积之和![]() ,所得混合溶液的
,所得混合溶液的![]() ,则
,则![]() __________。此溶液中各种离子的浓度由大到小的排列顺序是__________________。
__________。此溶液中各种离子的浓度由大到小的排列顺序是__________________。
![]() 分别向等体积、相同pH的HCl溶液和
分别向等体积、相同pH的HCl溶液和![]() 溶液中加入足量的Zn粉,反应刚开始时产生
溶液中加入足量的Zn粉,反应刚开始时产生![]() 的速率:
的速率:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”下同
”下同![]() ,反应完全后,所得氢气的质量:
,反应完全后,所得氢气的质量:![]() 盐酸_______
盐酸_______![]() 醋酸。
醋酸。