题目内容
在实验室中,为验证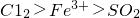 的氧化性顺序,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已省略,气密性已经检验).
的氧化性顺序,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已省略,气密性已经检验).
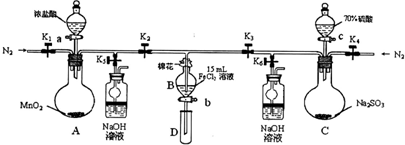
(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是______.
(2)关闭K1、K3、K4,打开活塞a,滴加一定量的浓盐酸,给A加热,A中发生反应的离子方程式为______.
(3)当B中的溶液变黄时,停止加热,夹紧弹簧夹K2并打开K5,这样做的原因是______.
(4)打开活塞b,使约2mL的溶液流入试管D中,滴入______可以证明其中是否含有Fe3+离子.
(5)打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3并打开K6,用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______.
(6)更新试管D,打开活塞b,使约2mL的溶液流入试管D中,检验B溶液中的离子.检验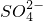 所需的试剂是______.
所需的试剂是______.
A.Ba(NO3)2溶液 B.BaC12溶液 C.AgNO3溶液 D.Ba(OH)2溶液
甲、乙、丙三位同学分别对两次B中得到的溶液进行了有关离子的检测,他们的检测结果一定能够证明氧化性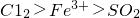 的是______.
的是______.
| 第一次B中溶液含有离子 | 第二次B中溶液含有离子 | |
| 甲 | 有Fe2+,无Fe3+ | 有SO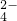 |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO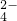 |
| 丙 | 有Fe3+,无Fe2+ | 有Fe2+ |
解:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气,故答案为:排出装置中的氧气;
(2)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水,该反应为MnO2+4H++2Cl- Mn2++Cl2↑+H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+H2O,故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+H2O;
Mn2++Cl2↑+H2O;
(3)当B中的溶液变黄时,停止加热,夹紧弹簧夹K2并打开K5,目的是吸收多余的氯气,防止气体压强过大而导致危险,
故答案为:吸收多余的氯气,防止气体压强过大而导致危险;
(4)氯气与氯化亚铁反应生成铁离子,铁离子遇KSCN溶液变为血红色,则滴入KSCN溶液可以证明其中是否含有Fe3+离子,故答案为:KSCN溶液;
(5)因氢离子浓度越大,反应速率越快,则70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大,所以反应速率快,
故答案为:70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大;
(6)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;棉花中浸有NaOH溶液,吸收多余氯气、二氧化硫,防止污染空气,
故答案为:B;乙、丙;NaOH溶液;吸收多余氯气、二氧化硫,防止污染空气.
分析:(1)通入一段时间N2,排出装置中的氧气;
(2)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水;
(3)夹紧弹簧夹K2并打开K5,吸收多余的氯气,防止气体压强增大导致危险;
(4)铁离子遇KSCN溶液变为血红色;
(5)氢离子浓度越大,反应速率越快;
(6)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;棉花中浸有NaOH溶液吸收氯气、二氧化硫,防止污染空气.
点评:本题考查性质实验方案的设计及氧化还原反应,明确装置的作用及发生的反应是解答的关键,注意氧化性的比较是解答的难点,题目难度较大.
(2)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水,该反应为MnO2+4H++2Cl-
 Mn2++Cl2↑+H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+H2O,故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+H2O;
Mn2++Cl2↑+H2O;(3)当B中的溶液变黄时,停止加热,夹紧弹簧夹K2并打开K5,目的是吸收多余的氯气,防止气体压强过大而导致危险,
故答案为:吸收多余的氯气,防止气体压强过大而导致危险;
(4)氯气与氯化亚铁反应生成铁离子,铁离子遇KSCN溶液变为血红色,则滴入KSCN溶液可以证明其中是否含有Fe3+离子,故答案为:KSCN溶液;
(5)因氢离子浓度越大,反应速率越快,则70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大,所以反应速率快,
故答案为:70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大;
(6)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;棉花中浸有NaOH溶液,吸收多余氯气、二氧化硫,防止污染空气,
故答案为:B;乙、丙;NaOH溶液;吸收多余氯气、二氧化硫,防止污染空气.
分析:(1)通入一段时间N2,排出装置中的氧气;
(2)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水;
(3)夹紧弹簧夹K2并打开K5,吸收多余的氯气,防止气体压强增大导致危险;
(4)铁离子遇KSCN溶液变为血红色;
(5)氢离子浓度越大,反应速率越快;
(6)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;棉花中浸有NaOH溶液吸收氯气、二氧化硫,防止污染空气.
点评:本题考查性质实验方案的设计及氧化还原反应,明确装置的作用及发生的反应是解答的关键,注意氧化性的比较是解答的难点,题目难度较大.

练习册系列答案
相关题目