题目内容
2.对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )| A. | M、N、Q三种物质的浓度一定相等 | B. | 反应物和生成物的浓度都保持不变 | ||
| C. | M、N全部变成了Q | D. | 反应已经停止 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、化学平衡状态时,M、N、Q三种物质的浓度不变,而不一定相等,故A错误;
B、达平衡状态时,反应物和生成物的浓度都保持不变,故B正确;
C、可逆反应是反应物和生成物共存的体系,所以M、N不可能全部变成了Q,故C错误;
D、化学平衡是动态平衡,达平衡时正逆反应仍在进行,速率相等,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
12.分类是学习和研究化学的一种重要方法.下列分类不合理的是( )
| A. | Na2SiO3和KHCO3都属于盐 | B. | KOH和NH3都属于碱 | ||
| C. | H2SO4和H2S都属于酸 | D. | CaO和NO都属于氧化物 |
13. 2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素结构简式如图所示.己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”.下列有关青蒿素的说法不正确的是( )
2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素结构简式如图所示.己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”.下列有关青蒿素的说法不正确的是( )
 2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素结构简式如图所示.己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”.下列有关青蒿素的说法不正确的是( )
2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素结构简式如图所示.己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”.下列有关青蒿素的说法不正确的是( )| A. | 青蒿素分子有6个手性碳原子 | |
| B. | 青蒿素的化学式为:C15H22O5 | |
| C. | 青蒿素在一定条件下能与NaOH溶液反应,且有氧化性 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
10. 在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
 在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )| A. | 碳棒上有气体放出,溶液c(H+)减小 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电子从a极到b极 | |
| D. | a极上发生了氧化反应 |
17.金属元素钫(Fr)在自然界中含量极少.它的21个已知同位素都有放射性.它是碱金属元素中最重的元素.根据它在周期表中的位置预言其性质,其中不正确的是( )
| A. | 在已知碱金属元素中具有最大的原子半径 | |
| B. | 其氧化物对应的水化物是极强的碱 | |
| C. | 在空气中燃烧时生成氧化物Fr2O | |
| D. | 在已知碱金属元素单质中熔点最低 |
7.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 11.2 LNH3所含分子数为0.5NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 23g金属钠与氧气加热生成Na2O2的反应,转移的电子数为2NA | |
| D. | 5.6g铁与足量的盐酸反应,失去的电子数为0.2NA |
14.化学能与热能、电能等能相互转化.则化学能与其他能量相互转化说法正确的是( )
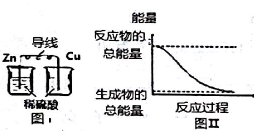

| A. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| B. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图Ⅱ所示的反应为吸热反应 |
16.有关化学用语表达错误的是( )
| A. | 乙酸乙酯的结构简式为:CH3COOCH2CH3 | |
| B. | CH4分子的球棍模型 | |
| C. | 甲苯的化学式:C7H8 | |
| D. | 环丙烷的键线式为: |
