题目内容
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b
C.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(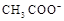 )+c(
)+c( )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+)
【答案】
C D
【解析】
试题分析:A、正确,CH3COOH>H2CO3>HCN>HCO3—酸性越强对应的盐水解能力越弱,等物质的量浓度的各溶液pH越小;B、正确,CN― 离子要水解,现c(Na+)=c(CN-),HCN一定要过量,a一定大于b;C、不正确,质子守恒的式子为:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);D、不正确,
考点:水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较

练习册系列答案
相关题目
