题目内容
新型锂离子电池材料Li2 MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2 MSiO4有两种方法:
方法一:固相法,2Li2SiO3+
FeSO4 Li2FeSiO4 +Li2SO4
+SiO2
Li2FeSiO4 +Li2SO4
+SiO2
方法二:溶胶—凝胶法,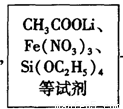
 Li2FeSiO4
Li2FeSiO4
(1)固相法中制备Li2 FeSiO4过程采用惰性气体气氛,其原因是 ;
(2)溶胶—凝胶法中,检查溶液中有胶体生成的方法是 ;生产中生成Imol Li2FeSiO4整个过程转移电子物质的量为 mol;
(3)以Li2 FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为:Li+ LiFeSiO4 Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
(4)使用(3)组装的电池必须先____ 。
(11分)(1)防止Fe2+被氧化成Fe3+ (2分) ;
(2)用一束强光照射溶液,从侧面能观察到一条光亮的通路。(2分);1mol (2分)
(3)嵌有Li的石墨(2分) Li2FeSiO4-e-=LiFeSiO4+Li+(2分) (4)充电(1分)
【解析】
试题分析:(1)Fe2+具有还原性,故采用惰性气体气氛的原因是防止Fe2+被氧化成Fe3+。
(2)检查有无胶体生成,利用胶体的特征现象,即用一束强光照射溶液,从侧面能观察到一条光亮的通路。
(3)电池的负极失去电子、化合价升高,故负极是嵌有Li的石墨。阳极失去电子,化合价升高,电极式为Li2FeSiO4-e-=LiFeSiO4+Li+。
(4)使用(3)组装的电池必须先充电。
考点:锂电池的制备原理 信息题
点评:本题考查的是锂电池的制备原理的信息题,题目难度大,利用好题中信息是解题的关键。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
(2)500°C、50Mpa时,在容积为VL的定容容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a.则容器内气体的压强反应前与平衡时的比值为______.
(3)若把标准状况下4.48L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是______,溶液中离子浓度从大到小的顺序是______.
(4)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.有沉淀析出的是______点(填字母).a点对应的Ksp ______c点对应的Ksp (填大于、等于或小于)
(5)以磷酸亚铁锂(LiFePO4)为电极材料的新型锂离子电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为______.