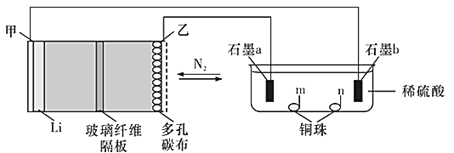
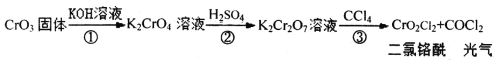
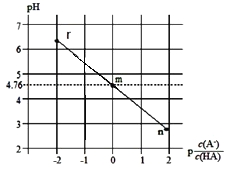
题目内容
【题目】已知:[FeCl4(H2O)2]-呈黄色,由下列实验所得结论不正确的是( )
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色加深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略溶液体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在平衡:Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④中,可证明升高温度,Fe3+水解平衡一定正向发生移动
【答案】D
【解析】
A. 加热促进水解,Fe3+ +3H2O![]() Fe(OH)3+3H+,实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3,A正确;
Fe(OH)3+3H+,实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3,A正确;
B. 由Fe3+ +3H2O![]() Fe(OH)3+3H+可知,酸化后加热溶液颜色无明显变化,H+抑制水解,实验②中,酸化对Fe3+水解的影响程度大于温度的影响,B正确;
Fe(OH)3+3H+可知,酸化后加热溶液颜色无明显变化,H+抑制水解,实验②中,酸化对Fe3+水解的影响程度大于温度的影响,B正确;
C. 加入NaCl后,溶液立即变为黄色,发生Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-,[FeCl4(H2O)2]-呈黄色,加热时平衡正向移动,溶液颜色加深,C正确;
[FeCl4(H2O)2]-,[FeCl4(H2O)2]-呈黄色,加热时平衡正向移动,溶液颜色加深,C正确;
D. 实验④中,存在Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-,升高温度平衡正向移动,溶液颜色加深,不能证明升高温度,Fe3+水解平衡一定正向发生移动,D错误;
[FeCl4(H2O)2]-,升高温度平衡正向移动,溶液颜色加深,不能证明升高温度,Fe3+水解平衡一定正向发生移动,D错误;
答案为D。

【题目】某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图,反应在t1 min时到达平衡,如图所示:
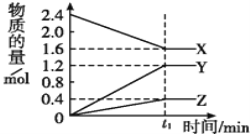
(1)该反应的化学方程式是_________。若t1=10min,用X表示化学反应速率为_________
(2)若上述反应中X,Y,Z分别为NH3、H2、N2, 且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为_______;
(3)保持容器温度不变,缩小容器体积,化学反应速率_______(填“增大”或“减小”或“不变”)。化学平衡常数K_______ (填“增大”或“减小”或“不变”)
(4)在一定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________
②能判断该反应达到化学平衡状态的依据是_______
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__________℃;
(6)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L-1,c(H2)=1.5mol·L-1,c(CO)=1mol·L-1,c(H2O)=3mol·L-1,则下一时刻,反应向__________(填"正反应"或"逆反应")方向进行。