题目内容
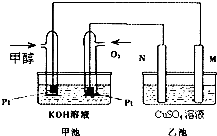 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1.请回答下列问题:(1)N的电极反应式为
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气为多少
(3)在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入
(4)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为碱性,负极的反应式为
(6)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为
考点:化学电源新型电池,电解原理
专题:电化学专题
分析:(1)燃料电池的正极上是氧气发生得电子的还原反应,负极上是燃料失电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,和电源的负极相连的是阴极,该极上发生得电子的还原反应;
(2)根据电极反应式结合电子守恒来计算;
(3)根据电极反应式结合电子守恒来计算;
(4)根据H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1,结合热化学方程式的意义来回答;
(5)氢氧燃料电池中,乙醇从负极通入,在反应中失电子被氧化,碱性条件下生成碳酸根离子和水,燃料电池的总反应是燃料燃烧的化学方程式;
(6)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来计算压强之比;根据压强对平衡移动的影响来确定平衡的移动方向.
(2)根据电极反应式结合电子守恒来计算;
(3)根据电极反应式结合电子守恒来计算;
(4)根据H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1,结合热化学方程式的意义来回答;
(5)氢氧燃料电池中,乙醇从负极通入,在反应中失电子被氧化,碱性条件下生成碳酸根离子和水,燃料电池的总反应是燃料燃烧的化学方程式;
(6)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来计算压强之比;根据压强对平衡移动的影响来确定平衡的移动方向.
解答:
解:(1)燃料电池的正极上是氧气发生得电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,所以N是阳极,该极上电极反应为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
(2)乙池中M电极析出金属铜6.4g,根据电极反应:Cu2++2e-=Cu,析出金属铜6.4g即0.1mol,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)乙池中发生的反应分别是:阳极上:4OH-=O2↑+2H2O+4e-,阳极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol?L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,甲醇燃料电池的负极上发生反应:CH3OH+8OH--6e-=CO32-+6H2O,当转移电子是1.2mol,消耗甲醇的物质的量是0.2mol,质量是0.2mol×32g/mol=6.4g,
故答案为:6.4;
(4)已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1,即:
①2H2(g)+O2(g)=2H20(l);△H=-572kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-560.0kJ?mol-1
③2CH3OH(l)+3O2(g)=2CO2(g)+4 H2O(l)△H=-1472kJ?mol-1
根据盖斯定律,则CH3OH(l)+O2(g)=CO(g)+2H2O(l)是反应③×
-②×
得到,所以反应的△H=-456 kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-456 kJ?mol-1
(5)在甲醇燃料电池的负极上是甲醇失电子的氧化反应,在碱性电解质下,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O,总反应是甲醇燃烧的方程式,即2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;2CH3OH+3O2+4OH-=2CO32-+6H2O;
(6)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 1 3 0 0
变化 a 3 a a a
平衡 1-a 3-3a a a
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为
=
,若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,由于反应中气体的物质的量
是减小的,所以恒压相当于在恒容的基础上加大压强,平衡会正向移动,CO2转化率会增大,即a<b.
故答案为:
;<.
(2)乙池中M电极析出金属铜6.4g,根据电极反应:Cu2++2e-=Cu,析出金属铜6.4g即0.1mol,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)乙池中发生的反应分别是:阳极上:4OH-=O2↑+2H2O+4e-,阳极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol?L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,甲醇燃料电池的负极上发生反应:CH3OH+8OH--6e-=CO32-+6H2O,当转移电子是1.2mol,消耗甲醇的物质的量是0.2mol,质量是0.2mol×32g/mol=6.4g,
故答案为:6.4;
(4)已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ?g-1、10kJ?g-1和23kJ?g-1,即:
①2H2(g)+O2(g)=2H20(l);△H=-572kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-560.0kJ?mol-1
③2CH3OH(l)+3O2(g)=2CO2(g)+4 H2O(l)△H=-1472kJ?mol-1
根据盖斯定律,则CH3OH(l)+O2(g)=CO(g)+2H2O(l)是反应③×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-456 kJ?mol-1
(5)在甲醇燃料电池的负极上是甲醇失电子的氧化反应,在碱性电解质下,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O,总反应是甲醇燃烧的方程式,即2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;2CH3OH+3O2+4OH-=2CO32-+6H2O;
(6)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 1 3 0 0
变化 a 3 a a a
平衡 1-a 3-3a a a
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为
| 1-a+3-3a+a+a |
| 1+3 |
| 2-a |
| 2 |
是减小的,所以恒压相当于在恒容的基础上加大压强,平衡会正向移动,CO2转化率会增大,即a<b.
故答案为:
| 2-a |
| 2 |
点评:本题综合考查学生热化学方程式的书写、电解池和燃料电池的工作原理、化学平衡的影响因素和计算等知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
下列有关容量瓶使用方法的操作中,正确的是( )(填字母代号).
| A、使用容量瓶前检查它是否漏水 |
| B、容量瓶用蒸馏水洗净后,再用待配溶液润洗 |
| C、配制1mol/LNaOH溶液时,NaOH在烧杯中溶解后立即转入容量瓶 |
| D、配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2~3cm处,用滴管滴加蒸馏水到刻度线 |
| E、盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次 |
下列说法正确的是( )
| A、物质失去电子数越多,物质的还原性越强 |
| B、导电的不一定是电解质,电解质不一定导电 |
| C、得到电子的物质是还原剂 |
| D、还原剂反应后得到是还原产物 |
 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
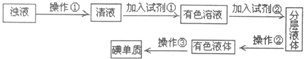
 实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)
实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)