题目内容
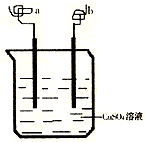 (2010?临沂一模)如图所示,a、b两电极材料分别为铁丝和铜丝.则以下说法不正确的是( )
(2010?临沂一模)如图所示,a、b两电极材料分别为铁丝和铜丝.则以下说法不正确的是( )分析:该装置中如果有外接电源,就构成电解池;如果没有外接电源,就构成原电池.如果构成电解池时,连接电源负极的电极是阴极,阴极上得电子发生还原反应,连接电源正极的电极是阳极,阳极上失电子发生氧化反应;如果构成原电池,较活泼的金属铁作负极,负极上铁失电子发生氧化反应,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应.
解答:解:A、该装置中如果有外接电源,就构成电解池;如果没有外接电源,就构成原电池,故A正确;
B、如果该装置连接外接电源,且a连接电源负极,a就是电解池中的阴极,阴极上溶液中的铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故B正确;
C、如果该装置为原电池时,较活泼的金属铁作负极,较不活泼的金属铜作正极,正极上铜离子得电子生成铜单质附着在电极上,电极反应式为Cu2++2e-═Cu,导致b极质量增加;如果该装置有外接电源,且b连接原电池负极,b为电解池的阴极,阴极上溶液中的铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,导致b极质量增加,故C正确;
D、该装置构成原电池时,负极上铁失电子,正极上铜离子得电子;构成电解池,阳极上铁或铜失电子,阴极上铜离子得电子,所以无论是原电池还是电解池都没有大量气体产生,故D错误.
故选D.
B、如果该装置连接外接电源,且a连接电源负极,a就是电解池中的阴极,阴极上溶液中的铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故B正确;
C、如果该装置为原电池时,较活泼的金属铁作负极,较不活泼的金属铜作正极,正极上铜离子得电子生成铜单质附着在电极上,电极反应式为Cu2++2e-═Cu,导致b极质量增加;如果该装置有外接电源,且b连接原电池负极,b为电解池的阴极,阴极上溶液中的铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,导致b极质量增加,故C正确;
D、该装置构成原电池时,负极上铁失电子,正极上铜离子得电子;构成电解池,阳极上铁或铜失电子,阴极上铜离子得电子,所以无论是原电池还是电解池都没有大量气体产生,故D错误.
故选D.
点评:本题考查了原电池和电解池原理,难度不大,注意铁和铜都是较活泼的金属,作电解池阳极时,金属材料失电子,不是溶液中的阴离子失电子.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
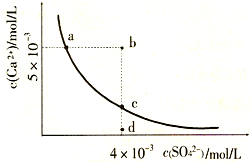 (2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
(2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
 (2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: