题目内容
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡有白色沉淀生成。
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液,滴加稀硫酸,有白色沉淀生成。
④另取少量②的溶液,滴加AgNO3溶液,有白色沉淀生成。
请回答:
(1)根据上述实验现象,判断原白色粉末的组成成分是___________(填写名称)。
(2)写出①—④中涉及的化学方程式:
①______________________________
②_____________________________
③______________________________
④_____________________________
(1)硝酸钡、氯化钙、碳酸钾
(2)①Ba(NO3)2+K2CO3==BaCO3↓+2KNO3 CaCl2+K2CO3==CaCO3↓+2KCl
②BaCO3+2HNO3==Ba(NO3)2+CO2↑+H2O CaCO3+2HNO3==Ca(NO3)2+CO2↑+H2O
③Ba(NO3)2+H2SO4==BaSO4↓+2HNO3
④KCl+AgNO3==KNO3+AgCl↓
解析:
[思路分析] 本题考查物质的检验。由题中实验的明显实验现象,由①②可推知一定含有K2CO3,Ba(NO3)2、CaCl2中至少含有一种;由③可推知②的溶液中含有Ba2+,证明原物质含有Ba(NO3)2;由④可推知②的溶液中含有Cl―,证明原物质含有CaCl2。
提示:由明显的现象推断出某离子后,还应分析这种离子是原物质中的,还是加入新试剂带入的。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
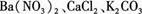 ,现做以下实验。
,现做以下实验。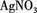 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。 现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。
现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。