题目内容
10.肉桂酸乙酯是生产治疗慢性肾病药物盐酸西那卡塞的重要原料.其合成路线如下: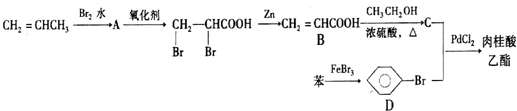
已知:
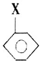 +CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$
+CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$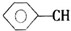 =CHCOOCH3+HX(X为卤素原子)
=CHCOOCH3+HX(X为卤素原子)(1)有机物A的名称是1,2-二溴丙烷.
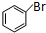
(2)鉴别有机物B、D和甲苯,最佳试剂是c(填写序号).
a.银氨溶液 b.酸性KMnO4溶液 c.溴水 d.四氯化碳
(3)写出C与D反应生成肉桂酸乙酯的化学方程式
 +CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$
+CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$ +HBr.
+HBr.(4)肉桂酸乙酯有多种同分异构体,其中符合下列条件的共有6种.
①能发生水解反应和银镜反应;②苯环上有两个取代基,其中一个为-CH=CH2.
(5)肉桂酸乙酯在酸性条件下水解得到乙醇和有机物E,E在一定条件下可以生成高聚物F,F的结构简式为
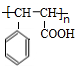 .
.
分析 CH2=CHCH3与溴发生加成反应生成A为BrCH2CHBrCH3,发生氧化反应得到 ,
, 发生消去反应得到CH2=CHCOOH,CH2=CHCOOH与乙醇发生酯化反应生成C为CH2=CHCOOCH2CH3,苯与液溴发生取代反应生成溴苯,溴苯与CH2=CHCOOCH2CH3发生信息中的取代反应生成肉桂酸乙酯,其结构简式为
发生消去反应得到CH2=CHCOOH,CH2=CHCOOH与乙醇发生酯化反应生成C为CH2=CHCOOCH2CH3,苯与液溴发生取代反应生成溴苯,溴苯与CH2=CHCOOCH2CH3发生信息中的取代反应生成肉桂酸乙酯,其结构简式为 ,据此解答.
,据此解答.
解答 解:CH2=CHCH3与溴发生加成反应生成A为BrCH2CHBrCH3,发生氧化反应得到 ,
, 发生消去反应得到CH2=CHCOOH,CH2=CHCOOH与乙醇发生酯化反应生成C为CH2=CHCOOCH2CH3,苯与液溴发生取代反应生成溴苯,溴苯与CH2=CHCOOCH2CH3发生信息中的取代反应生成肉桂酸乙酯,其结构简式为
发生消去反应得到CH2=CHCOOH,CH2=CHCOOH与乙醇发生酯化反应生成C为CH2=CHCOOCH2CH3,苯与液溴发生取代反应生成溴苯,溴苯与CH2=CHCOOCH2CH3发生信息中的取代反应生成肉桂酸乙酯,其结构简式为 .
.
(1)有机物A为BrCH2CHBrCH3,名称是:1,2-二溴丙烷,
故答案为:1,2-二溴丙烷;
(2)a.银氨溶液与CH2=CHCOOH、甲苯、溴苯均不反应,与前者互溶,或后来者分层,有机层分别在上层及下层,没有颜色变化,可以鉴别;
b.CH2=CHCOOH、甲苯均使酸性KMnO4溶液褪色,不能甲苯
c.溴水与CH2=CHCOOH与溴发生加成反应使溶液褪色,甲苯、溴苯均易溶解溴,溶液分层,甲苯有机层在上层,而溴苯在下层,颜色变化明显,比a更好;
d.CH2=CHCOOH、甲苯、溴苯均与四氯化碳混溶,不能鉴别,
故选:c;
(3)C与D反应生成肉桂酸乙酯的化学方程式: +CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$
+CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$ +HBr,
+HBr,
故答案为: +CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$
+CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$ +HBr;
+HBr;
(4)肉桂酸乙酯( )有多种同分异构体,其中符合下列条件:①能发生水解反应和银镜反应,含有甲酸形成的酯基(-OOCH);②苯环上有两个取代基,其中一个为-CH=CH2,另外取代基为-CH2CH2OOCH或-CH(CH3)OOCH,各有邻、间、对3种,故共有6种,
)有多种同分异构体,其中符合下列条件:①能发生水解反应和银镜反应,含有甲酸形成的酯基(-OOCH);②苯环上有两个取代基,其中一个为-CH=CH2,另外取代基为-CH2CH2OOCH或-CH(CH3)OOCH,各有邻、间、对3种,故共有6种,
故答案为:6;
(5)肉桂酸乙酯在酸性条件下水解得到乙醇和有机物E,则E为 ,在一定条件下可以生成高聚物F,则F的结构简式为
,在一定条件下可以生成高聚物F,则F的结构简式为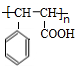 ,
,
故答案为: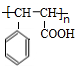 .
.
点评 本题考查有机物的推断与合成,注意根据有机物的结构与反应条件进行分析解答,需要学生熟练掌握官能团的性质与转化,难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | 标况下11.2L乙烷分子中所含分子数为0.5NA | |
| B. | 1.8g的NH4+中含有的电子数为0.1NA | |
| C. | 20克氖气所含原子数为0.5NA | |
| D. | 常温常压下,48g O3和O2的混合气体中,含有氧原子数为3NA |
 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1
③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1
写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1.
Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g)$?_{加热}^{催化剂}$SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})•c(O{\;}_{2})}$.
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是BC(填字母).
A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大
C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.平衡后升高温度,平衡常数K增大
(3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | Y | t |
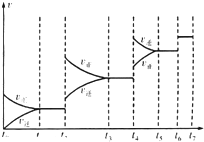
(4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;图中表示平衡混合物中SO2的转化率最高的一段时间是t3~t4.
| 选项 | 用途 | 解释 |
| A | 硅胶可作袋装食品的干燥剂 | 硅胶多孔,吸收空气中氧气的能力强 |
| B | CuSO4可作游泳池的消毒剂 | 铜盐能使构成病毒的蛋白质变性 |
| C | 浸有高锰酸钾溶液的硅藻土可作某些水果的保鲜剂 | 高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| D | Na2O2可作呼吸面具中的供氧剂 | Na2O2能吸收CO2同时放出O2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 231.5mL | B. | 268.8mL | C. | 287.5mL | D. | 313.6mL |


 某化合物由阳离子[(CH3)4 N]+和阴离子A按个数比4:1组成,阴离子A的结构如图所示:
某化合物由阳离子[(CH3)4 N]+和阴离子A按个数比4:1组成,阴离子A的结构如图所示: