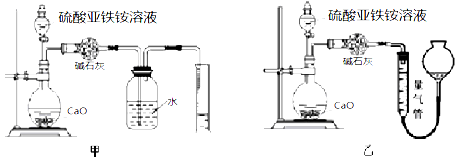
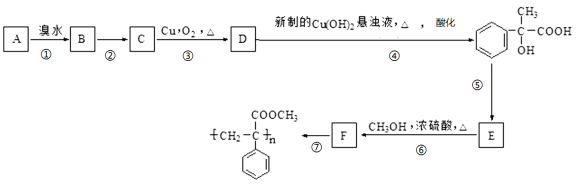
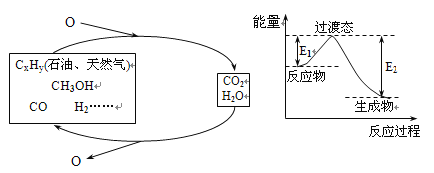
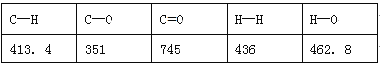
题目内容
【题目】溶液的pH、体积相同的盐酸和醋酸两种溶液,下列叙述错误的是
A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH少
B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的n(Cl-)= n(CH3COO-)相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
【答案】AB
【解析】
试题分析: 溶液的pH、体积相同的盐酸和醋酸,醋酸的物质的量比盐酸大的多,因此完全中和时醋酸需要氢氧化钠比盐酸多,他们分别和足量碳酸钙反应时,醋酸产生的二氧化碳多,A、B错误;盐酸中HCl完全电离HCl==H++Cl-,醋酸溶液中CH3COOH![]() CH3COO-+H+,两溶液中pH相同,c(H+)相等则n(Cl-)=n(CH3COO-),C正确。稀释相同倍数时,促进CH3COOH的电离,则n(Cl-)<n(CH3COO - )。
CH3COO-+H+,两溶液中pH相同,c(H+)相等则n(Cl-)=n(CH3COO-),C正确。稀释相同倍数时,促进CH3COOH的电离,则n(Cl-)<n(CH3COO - )。

练习册系列答案
相关题目