题目内容
【题目】
I.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
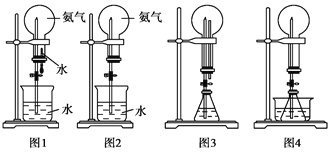
(1)实验室制取氨气的化学方程式____ __。
①用图1装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是___________。
②如果只提供如图2的装置, (“能”或“不能”)实现喷泉实验
(2)利用图3装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________。
A.Cu与稀盐酸 B.NaHCO3溶液与NaOH溶液
C.CaCO3与稀H2SO4D.NH4HCO3与稀盐酸
(3)在图4锥形瓶中加入酒精,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是________。
A.浓硫酸 B.食盐
C.硝酸钾 D.硫酸铜

(4)从产生喷泉的原理分析,图 是减小上部烧瓶内的压强。图 是增大下部锥形瓶内气体的压强。人造喷泉及火山爆发的原理与上述装置图________原理相似。(均填序号)
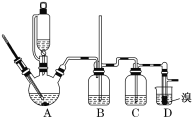
II.某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。
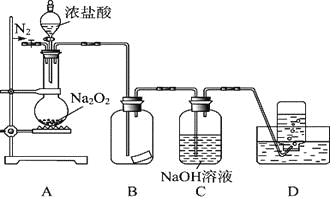
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为
① ;② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
Na2O2 + HCl ----- Cl2 + NaCl +
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出一个要点即可)。
【答案】I.(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分)
①打开止水夹,挤压胶头滴管(1分)②能(2)D(3)A(4)1、2;3、4;3
II.(1)Cl2(1分)4H++4I-+O2=2I2+2H2O(或4I-+O2+2H2O=2I2+4OH-)(2分)
(2)吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气(2分)
(3)①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2(1分)
②O2有可能是Na2O2与盐酸中的H2O反应生成的(1分)
(4)![]() 不能(1分)实验室没有可直接使用的干燥HCl气体的物质;固体与气体反应较慢;产生的氯气中含有大量的氯化氢气体(答出任何一点即可,其他合理答案均可)(1分)
不能(1分)实验室没有可直接使用的干燥HCl气体的物质;固体与气体反应较慢;产生的氯气中含有大量的氯化氢气体(答出任何一点即可,其他合理答案均可)(1分)
【解析】试题分析:Ⅰ、(1)实验室制取氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
①用图1装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是打开止水夹,挤压胶头滴管。
②氨气是一种极易溶于水的气体,打开夹子,用手(或热毛巾等)将烧瓶捂热,部分氨气溶于水形成压强差,在外界气压的作用下,水被压到瓶内,形成喷泉现象;
(2)①铜和盐酸不反应,不能形成喷泉,A不正确;B中没有气体,不能形成压强差,B不正确;稀硫酸和碳酸钙反应生成微溶的硫酸钙,使反应不能进行,C不正确;D中生成CO2气体,反应的方程式是NH4HCO3+HCl=NH4Cl+H2O+CO2↑。答案选D。
(3)浓硫酸遇水被稀释,释放出大量的热,使锥形瓶中的乙醇挥发,压强增大,形成喷泉,而其它物质都不能达到溶于水而放出大量的热的目的,答案选A;
(4)从产生喷泉的原理分析,图1、2是减小上部烧瓶内的压强。图3、4是增大下部锥形瓶内气体的压强。城市中常见的人造喷泉及火山爆发的原理都是通过增加容器中的压强完成的,所以与图3原理相似;
Ⅱ、(1)湿润的红色石蕊试纸褪色,说明有HClO生成,氯气和水反应生成HClO,所以说明装置A中有Cl2生成;若B中改放湿润的淀粉KI试纸,碘离子具有还原性,O2、Cl2都具有强氧化性,都能将碘离子氧化为I2,I2遇淀粉试液变蓝色,发生的离子反应方程式为4H++4I-+O2=2I2+2H2O(或4I-+O2+2H2O=2I2+4OH-),所以不能据此证明上述结论;
(2)Cl2有毒不能直接排空,如果O2中混有Cl2,会导致收集的O2不纯净,且盐酸具有挥发性,导致生成的气体中含有HCl,氯气、HCl都能和NaOH反应而除去,则NaOH的作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气;
(3)①如果Na2O2被还原,则O元素应该得电子化合价降低,不能是化合价升高,Na2O2被还原时氧元素的化合价应该降低,不可能得到O2;②水和过氧化钠反应也生成氧气,O2有可能是Na2O2与盐酸中的H2O反应生成的;
(4)根据元素守恒知,生成物中还有水生成,该反应中O元素化合价由-1价变为-2价、Cl元素化合价由-1价变为0价,根据转移电子相等配平方程式为Na2O2+4HCl=Cl2+2NaCl+2H2O;实验室没有可直接使用的干燥HCl气体的物质、固体与气体反应较慢、产生的氯气中含有大量的氯化氢气体,所以该实验不能用于实验室快速制取纯净的Cl2。

 阅读快车系列答案
阅读快车系列答案