题目内容
【题目】可用水煤气还原法处理![]() ,其中一个反应为
,其中一个反应为![]()
![]() 。在一定压强下发生该反应,平衡时
。在一定压强下发生该反应,平衡时![]() 二氧化硫的转化率
二氧化硫的转化率![]() 与原料气投料比
与原料气投料比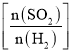 和温度
和温度![]() 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
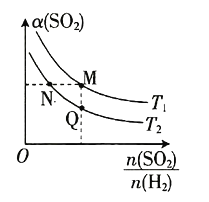
A.正反应的活化能![]() B.
B.![]() :
:![]()
C.逆反应速率:![]() D.增大压强,
D.增大压强,![]() 增大
增大
【答案】C
【解析】
A.根据反应热等于正反应活化能减去逆反应活化能,即![]() (正)-
(正)-![]() (逆
(逆![]() ,可知
,可知![]() ,故A不符合题意;
,故A不符合题意;
B. 的值越大,氢气的转化率越大,该反应为吸热反应,升高温度,
的值越大,氢气的转化率越大,该反应为吸热反应,升高温度,![]() 增大,根据图像可知
增大,根据图像可知![]() ,温度越高,氢气的转化率越大,故B不符合题意;
,温度越高,氢气的转化率越大,故B不符合题意;
C.正反应方向是吸热的反应,升高温度,平衡正向移动,![]() 增大,根据图像可知
增大,根据图像可知![]() ,温度越高,反应速率越快,
,温度越高,反应速率越快,![]() ,故C符合题意;
,故C符合题意;
D.正反应方向是体积减小的反应,增大压强,平衡正向移动,![]() 增大,故D符合题意;
增大,故D符合题意;
答案选C。

练习册系列答案
相关题目