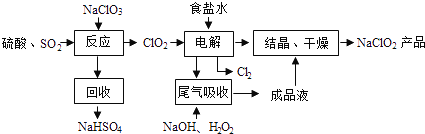
题目内容
【题目】2013年12月12日,中国矿业报报道中国地质科学院矿产综合利用研究所认定石龙铜矿含铜品位高(含铜3.27%)。已知铜矿物以黄铜矿、斑铜矿和辉铜矿为主。黄铜矿(CuFeS2)既是制取铜及其化合物的主要原料,又可以制备硫及铁的化合物。请回答下列问题:
(1)冶炼铜的反应方程式为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
(2)上述冶炼过程中产生大量二氧化硫,下列对其性质的描述中正确的是________(填序号)。
A.SO2既是氧化剂,又是还原剂
B.SO2是还原产物
C.SO2是形成酸雨的一种物质
D.SO2是氧化产物
(3)SO2的存在对CO2的检验会造成干扰,实验室常用酸性高锰酸钾溶液除去SO2,请写出该反应的化学方程式:________________________________。
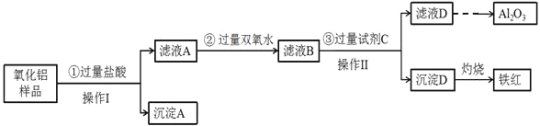
(4)利用黄铜矿冶炼产生的炉渣(含FeO、Fe2O3、SiO2、Al2O3)可制备Fe2O3。方法为先用稀盐酸浸取炉渣,过滤;将滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。用下列哪些试剂可以验证炉渣中含有FeO?________________(填序号)其中发生氧化还原反应的离子方程式为____________________。
A.稀盐酸 B.稀硫酸 C.KSCN溶液 D.KMnO4溶液 E.NaOH溶液 F.碘水
【答案】铜元素、氧元素 CD 5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4 BD 5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
【解析】
(1)得到电子化合价降低的元素被还原;
(2)根据二氧化硫的性质以及反应中硫元素的化合价变化分析解答;
(3)根据氧化还原反应中电子得失守恒以及原子守恒书写方程式;
(4)根据氧化亚铁中铁元素的化合价是+2价易被氧化分析解答。
(1)若CuFeS2中铁元素为+2价,则铜元素是+2价,硫元素是-2价。根据方程式可知反应后铜元素和氧元素化合价降低,所以反应中被还原的元素为铜元素和氧元素。
(2)A.反应中硫元素化合价升高,被氧化,所以SO2是氧化产物,A错误;
B.SO2是氧化产物,B错误;
C.SO2溶于水生成亚硫酸,亚硫酸被氧化生成硫酸,因此二氧化硫是形成酸雨的一种物质,C正确;
D.SO2是氧化产物,D正确;
答案选CD;
(3)SO2被酸性高锰酸钾溶液氧化生成硫酸,高锰酸钾被还原为锰离子,反应中硫元素化合价从+4价升高到+6价,失去2个电子,锰元素化合价从+7价降低到+2价,得到5个电子,因此根据电子得失守恒以及原子守恒可知该反应的化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;
(4)FeO中铁元素是+2价,可溶于酸生成亚铁离子,亚铁离子能使酸性高锰酸钾溶液褪色,由于盐酸也能被高锰酸钾溶液氧化,所以选择稀硫酸对炉渣进行浸取,答案选BD,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。