题目内容
某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0.反应物的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0.反应物的浓度(mol/L)随反应时间(min)的变化情况如下表:
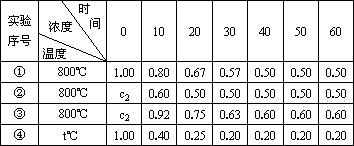
根据上述数据,完成下列填空:
(1)在实验①,反应在10~20 min内平均反应速率为________mol/L·min.
(2)在实验②,A的初始浓度为c2=________mol/L,反应经20 min就达到平衡,可推测实验②中还隐含的条件是________.
(3)设实验③的反应速率为v3,实验1的反应速率为v1,则v3________v1(填“>”、“=”或“<”=,且c3________1.0 mol/L(填“>”、“=”或“<”=
(4)比较实验④和实验①,可推测该反应和实验①相比较温度的改变是________(填“升高”、“降低”或“不变”),理由是________.
解析:
|
答案:(1)0.013 (2)1.0;催化剂 (3)>;> (4)升高;起始浓度与实验①相同,平衡浓度不相同,速率加快,而压强对此反应平衡没有影响,可推知是提高了反应温度 分析:该反应是气体之间的反应,因反应前后气体体积不变,因此不受压强的影响. (1)反应速率的求解比较简单,找出浓度变化量,除以反应时间即可. (2)实验②中的温度与实验①一样,达到平衡的浓度一样,说明起始浓度相同,但时间短,说明反应只是加快了反应速率,则使用了催化剂. (3)实验③的温度与实验①一样,但达到平衡的浓度高,且从同一时间段,10 min到20 min的速率和实验①相比要快,可知是浓度比实验①大. (4)比较实验④和实验①,可知,速率加快,而起始浓度与实验①相同,平衡浓度不相同,可知是起始条件不同的反应,由此,可推知是提高了反应温度. |
提示:
|
该题是一道综合性较强的习题,涉及内容较深,综合性较强.对学习较好的同学可钻研掌握,其他同学仅作为拓展性了解. |

某化学反应2A (g) ≒ B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:
| 实验 序号 | 浓度
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | ||
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | ||
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | ||
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1达到平衡的时间是 min,实验4达到平衡的时间是 min,
C3 1.0 mol?L-1(填“ < ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率 (填“快”或“慢”),原因是 。

 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
 B(g)+D(s)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始为0。反应物A的浓度(mol·L−1)随反应时间(min)的变化情况如下表:
B(g)+D(s)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始为0。反应物A的浓度(mol·L−1)随反应时间(min)的变化情况如下表:
 B(g)+D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(mol·L−1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(mol·L−1)随反应时间(min)的变化情况如下表: