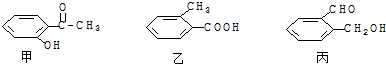
题目内容
常温下,用0.04mol/L NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时消耗NaOH溶液10mL,试求:
(1)此一元弱酸的物质的量浓度.
(2)求此条件下该一元弱酸的电离平衡常数.
(1)此一元弱酸的物质的量浓度.
(2)求此条件下该一元弱酸的电离平衡常数.
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)NaOH溶液滴定pH=3的一元弱酸HA的溶液20mL,达到终点时消耗NaOH溶液12.5mL,利用c酸V酸=c碱V碱计算;
(2)pH=3的一元弱酸HA的溶液中c(H+)=c(A-)=10-3mol/L,进而计算电离平衡时c(HA),再根据Ka=
计算.
(2)pH=3的一元弱酸HA的溶液中c(H+)=c(A-)=10-3mol/L,进而计算电离平衡时c(HA),再根据Ka=
| c(H+)?c(A-) |
| c(HA) |
解答:
解(1)NaOH溶液滴定pH=3的一元弱酸HA的溶液20mL,达到终点时消耗NaOH溶液10mL,由c酸V酸=c碱V碱可知,10×10-3L×0.04mol/L=c酸×20×10-3L,
解得c酸=0.02mol/L,
答:一元弱酸HA的物质的量浓度0.02mol/L;
(2)pH=3的一元弱酸HA的溶液中c(H+)=c(A-)=10-3mol/L,则:
HA?H++A-
10-3mol/L 10-3mol/L 10-3mol/L
故平衡时c(HA)=0.02mol/L-10-3mol/L≈0.02mol/L,
则Ka=
=
=5×10-5,
答:一元弱酸HA的电离平衡常数为5×10-5.
解得c酸=0.02mol/L,
答:一元弱酸HA的物质的量浓度0.02mol/L;
(2)pH=3的一元弱酸HA的溶液中c(H+)=c(A-)=10-3mol/L,则:
HA?H++A-
10-3mol/L 10-3mol/L 10-3mol/L
故平衡时c(HA)=0.02mol/L-10-3mol/L≈0.02mol/L,
则Ka=
| c(H+)?c(A-) |
| c(HA) |
| 10-3×10-3 |
| 0.02 |
答:一元弱酸HA的电离平衡常数为5×10-5.
点评:本题考查酸碱混合的计算、中和滴定、电离平衡常数计算等,难度不大,明确混合后溶液的pH判断过量是解答的关键,注意掌握pH值的计算.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
对下列说法不正确的是( )
| A、光化学烟雾的主要成分为氮的氧化物和碳氢化合物 |
| B、工业上可以从石油裂解气中获得乙烯 |
C、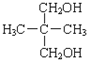 和 和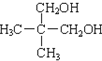 互为同分异构体 互为同分异构体 |
D、按系统命名法,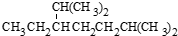 的名称为2,6-二甲基-3-乙基庚烷 的名称为2,6-二甲基-3-乙基庚烷 |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A、标准状况下,1L庚烷所含有的分子数为
| ||
| B、1mol甲基(-CH3)所含电子数为9NA | ||
| C、标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数为16NA | ||
| D、26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |