题目内容
反应SO2(g)+NO2(g)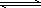 SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下.
SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下.
(1)此反应的平衡常数.
(2)若SO2(g)的初始浓度增大到3 mol/L,NO2(g)的初始浓度仍为2 mol/L,则SO2(g)、NO2(g)的转化率变为多少?
答案:
解析:
解析:
|
K=1(4分)转化率40%,60%(4分) |

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-197.74kJ?mol-1,4min后达到平衡,这时c(SO2)=0.2mol L-1,且SO2和O2的转化率相等.下列说法中,不正确的是( )
| 一定条件 |
| A、2min时,c(SO2)=0.6mol L-1 |
| B、用O2表示4min内的反应速率为0.1mol?(L?min)-1 |
| C、再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 |
| D、4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |
已知某温度下,反应 SO2(g)+NO2(g) SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是
SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是
A.该温度下反应2SO2(g)+2NO2(g) 2SO3(g)+2NO(g) 的平衡常数为0.48 2SO3(g)+2NO(g) 的平衡常数为0.48 |
| B.若该反应ΔH <0,则升高温度化学平衡常数K减小 |
| C.若升高温度,逆反应速率减小 |
| D.改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小 |
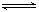 SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是
SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是
 ___Cu2++___Fe2++______+___SO42-
___Cu2++___Fe2++______+___SO42- 2SO3(g),该反应的平衡常数表达式为K=_______
2SO3(g),该反应的平衡常数表达式为K=_______