题目内容
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(2)浸出液中加入NaClO3的目的是____________________________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是_____(填化学式)。
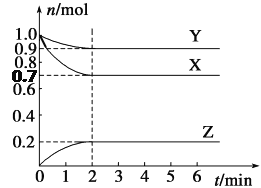
(4)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______;其使用的适宜pH范围是___。

A.2.02.5 B.3.03.5 C.4.04.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =____________。
【答案】SO32-+ Co2O3+4H+=2Co2++SO42-+2H2O 将浸出液中的Fe2+氧化成Fe3+ Fe(OH)3 除去溶液中的Mn2+ B 0.7
【解析】
浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;加入NaClO3可氧化亚铁离子,得到FeCl3,然后加入Na2CO3调节pH至5.2,可得Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要有Co2+、Mn2+、Ca2+、Mg2+,加入NaF,除去Ca2+、Mg2+,再在滤液中加入萃取剂,最后得到CoC2O4,据此分析。
(1)Na2SO3具有还原性,能将Co2O3还原为Co2+,Na2SO3被氧化为Na2SO4,所以离子方程式为:SO32-+Co2O3+4H+=2Co2++SO42-+2H2O,故答案为:SO32-+Co2O3+4H+=2Co2++SO42-+2H2O。
(2)氯酸钠具有氧化性,能将浸出的亚铁离子氧化成铁离子,所以加入NaClO3的目的是将浸出液中的Fe2+氧化成Fe3+,故答案为:将浸出液中的Fe2+氧化成Fe3+。
(3)加入的碳酸钠与H+反应,c(H+)降低,使Fe3+和Al3+的水解平衡Fe3++3H2O![]() Fe(OH)3+3H+、Al3++3H2O
Fe(OH)3+3H+、Al3++3H2O![]() Al(OH)3+3H+向右移动,从而产生氢氧化铁、氢氧化铝沉淀,故答案为:Fe(OH)3。
Al(OH)3+3H+向右移动,从而产生氢氧化铁、氢氧化铝沉淀,故答案为:Fe(OH)3。
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,加入萃取剂的作用是除去溶液中的Mn2+,由萃取剂对金属离子的萃取率与pH的关系图可知,调节溶液的pH在3.03.5之间,可使Mn2+完全萃取,并防止Co2+转化为Co(OH)2沉淀,故选B,故答案为:除去溶液中的Mn2+,B。
(5)当加入过量的氟化钠后,所得到滤液中镁离子与钙离子的比例等于氟化镁和氟化钙的溶度积的比值c(Mg2+)/c(Ca2+)=![]() =0.7,故答案为:0.7。
=0.7,故答案为:0.7。

【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解