题目内容
8.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的cd吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+(填离子符号),检验溶液中还存在Fe2+的方法是取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu.
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为16g.
分析 由流程可知,黄铜矿加入石英砂通入空气焙烧,可生成Cu2S、CuO,继续加入石英砂通入空气焙烧,生成Cu2O、Cu,生成气体A为二氧化硫,熔渣B为FeO等,Cu2O、Cu与铝在高温下发生铝热反应得到粗铜,电解可得到精铜,
(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,二氧化硫是酸性氧化物,结合选项中各物质的性质判断;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;
Fe2+具有还原性,可以利用KMnO4溶液检验;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu;
(4)根据元素守恒进行计算.
解答 解:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,
a、浓H2SO4不能吸收二氧化硫,故A错误;
b、稀HNO3可以吸收二氧化硫,但生成NO污染大气,故B错误;
c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故C正确;
d、氨水与二氧化硫反应生成亚硫酸铵,故D正确;
故选cd;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;
Fe2+具有还原性,可以利用KMnO4溶液检验,取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,
故答案为:Fe3+;取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu,
故答案为:3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+6Cu;
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况)即0.1mol,所得溶液的溶质为Cu(NO3)2,根据氮元素守恒可知,溶液中NO3-的物质的量为0.6mol-0.1mol=0.5mol,所以溶液中Cu2+的质量为$\frac{1}{2}$×0.5×64g=16g,所以另取等量的泡铜,用足量的H2还原,得到的铜的质量也应为16g,
故答案为:16g.
点评 本题考查了元素化合物的性质、电化学知识、离子检验、化学计算等知识点,难度中等,注意离子的检验是高考的热点,选取的试剂和检验离子反应后要有特殊现象,会运用知识迁移方法解决问题.

①核内质子数②核外电子数③最外层电子数④原子序数.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
| A. | 常温常压下,11.2LCO2所含的原子数为1.5NA | |
| B. | 常温常压下,48gO2与O3混合物含有的氧原子数为3NA | |
| C. | 标准状况下,22.4LCCl4中所含分子数为NA | |
| D. | 标准状况下,18g水所含原子数为NA |
| A. | 蒸馏法 | B. | 电渗析法 | C. | 热蒸发法 | D. | 离子交换法 |
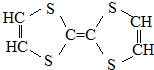
| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |

