题目内容
【题目】Ⅰ、在金刚石、CS2、N2、C2H4、H2O2、金属Fe 等六种晶体中:
(1)以非极性键结合的非极性分子是______________;
(2)通过非极性键形成的原子晶体是______________;
(3)含有极性共价键和非极性共价键的非极性分子是______________;
(4)固态和熔融状态下都能导电的晶体是______________;
Ⅱ、C和Si元素在化学中占有极其重要的地位.
(1)CO2属于______________晶体,熔化时克服的微粒间作用力是______________;SiO2属于______________晶体,熔化时克服的微粒间作用力是______________;所以熔点CO2 ______________SiO2(填“<”、“=”或“>”).
(2)SiO2晶体中每个硅与______________个O相连,每个氧与______________Si相连.
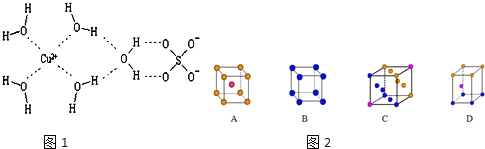
(3)石墨晶体中,层内形成正六边形的平面网状结构,试分析层内每个正六边形占有的碳原子数为___________个。

【答案】Ⅰ、(1)N2;
(2)金刚石;
(3)C2H4;
(4)金属Fe.
Ⅱ、(1)分子;分子间作用;原子;共价键;<;
(2)4;2;
(3)2
【解析】
试题分析:Ⅰ、(1)双原子单质分子是以非极性键结合的非极性分子,则N2是以非极性键结合的非极性分子,故答案为:N2;
(2)金刚石是通过非极性键形成的原子晶体,故答案为:金刚石;
(3)C2H4分子中含有C-H极性共价键和C-C非极性共价键的非极性分子,故答案为:C2H4;
(4)金属Fe中存在自由电子,所以固态和熔融状态下都能导电,故答案为:金属Fe.
Ⅱ、(1)CO2属于分子晶体,熔化时克服的微粒间作用力是分子间作用力;SiO2属于是原子晶体,熔化时克服的微粒间作用力是共价键,化学键比分子间作用强得多,所以二氧化硅熔点高于二氧化碳气体,故答案为:分子;分子间作用;原子;共价键;<;
(2)SiO2晶体是原子晶体,一个硅与四个氧相连,一个氧与两个硅相连形成正四面体,故答案为:4;2;
(3)石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6×![]() =2,故答案为:2。
=2,故答案为:2。