题目内容
测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:

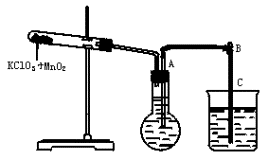
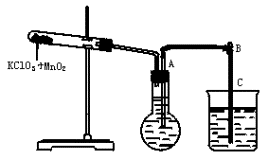
①按上图装配实验装置;
②洗净试管然后充分干燥;
③向500mL烧瓶里装满水,向500mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧;
④称得试管的质量为14.45g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95g;
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉;
⑥打开弹簧夹,加热试管中的混合物到不再产生气体,即水不再流向烧杯时为止;
⑦反应完毕后把装置放置冷却到室温;
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹;
⑨用500mL量筒测量烧杯中水的体积为285.0mL,把它换算为标准状况下的体积为279.7mL;
⑩再称量冷却后试管的质量为15.55g.
根据上述实验,回答下列问题:
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要浸在烧杯的水中,不能离开水面,其理由是________.
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?________.
(3)标准状况下,1mol氧气所占的体积为________L(列出计算式);混合物中MnO2的质量分数为________.
答案:
解析:
解析:
|
(1)温度降低时,烧瓶中的压强降低,这时烧杯中的水就会回流,从而可准确地求出气体的体积 (2)如果烧瓶中压强与外界大气压不一致,就不能准确地求出气体的体积 (3) |

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 ×1,32%
×1,32%