题目内容
6.按要求填空(均用序号表示):①O2和O3 ②一氯甲烷和二氯甲烷 ③正丁烷和异丁烷 ④CH4和
CH3CH2CH2CH3 ⑤CH3CH2CH(CH3)2 和
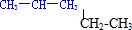 ⑥氕、氘和氚
⑥氕、氘和氚其中,
(1)互为同分异构体的是③;
(2)互为同系物的是④;
(3)实际上是同种物质的是⑤;
(4)互为同素异形体的是①
(5)互为同位素的是⑥.
分析 同素异形体是同种元素形成的不同单质;
具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;
具有相同分子式而结构不同的化合物互为同分异构体;
分子式相同结构相同的物质是同种物质;根据以上概念分析.
解答 解:①O2和O3是由氧元素组成的不同单质,互为同素异形体;
②一氯甲烷和二氯甲烷分别是甲烷的一元取代产物、二元取代产物,是不同得物质;
③正丁烷和异丁烷的分子式相同,结构不同,互为同分异构体;
④CH4和CH3CH2CH2CH3 都是烷烃,结构相似,在分子组成上相差3个CH2原子团,互为同系物;
⑤CH3CH2CH(CH3)2 和 的分子式相同,结构相同,是同种物质;
的分子式相同,结构相同,是同种物质;
⑥氕、氘和氚的质子数相同,中子数不同,互为同位素;
故答案为:(1)③;(2)④;(3)⑤;(4)①;(5)⑥.
点评 本题考查概念的辨析,侧重“五同”概念的考查,把握概念的要点及分析对象为解答的关键,题目较简单.

练习册系列答案
相关题目
18.下列物质的分类正确的是( )
| 单质 | 氧化物 | 酸 | 碱 | 盐 | |
| A | 钠 | 水 | 硝酸 | 小苏打 | 胆矾 |
| B | 生铁 | 硅酸钠 | H2SiO3 | KOH | NH4Cl |
| C | 晶体硅 | 过氧化钠 | 盐酸 | '纯碱 | 明矾 |
| D | 液氯 | 铁红 | 硫酸 | Ca(OH)2 | Na2SO4 |
| A. | A | B. | B | C. | C | D. | D |
19.2016年世界环境日,我国环保部公布中国主题为“改善环境质量,推动绿色发展”.下列做法与该主题相违背的是( )
| A. | 推广和鼓励多使用公共交通工具出行 | |
| B. | 植树造林,绿化环境 | |
| C. | 利用廉价煤炭,大力发展火力发电 | |
| D. | 对燃煤进行脱硫,减少空气的污染 |
16.国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来,下列说法正确的是( )
| A. | 字航员喝茶时注入的H2O的摩尔质量是18克 | |
| B. | H2O+Cl2?HCl+HClO这反应属于氧化还原反应 | |
| C. | 氢的三种同位素1H、2D、3T与18O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
1.实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4•7H2O).某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质.
(l)制备皓矾的实验流程如图所示.
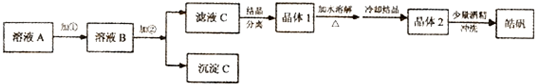
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
回答下列问题:
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
①加入的试剂①,应选用20%的H2O2,发生反应的离子方程式为2H++H2O2+2Fe2+=2Fe3++2H2O
②加入的试剂②,可选用ZnO或Zn(OH)2,其作用是调节溶液的pH至3.7-5.7,使Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质
③从晶体l→晶体2,该提纯过程的名称是重结晶.
④有同学提出,应将晶体1加入稀硫酸中溶解,请结合离子方程式解析Zn2++2H2O?Zn(OH)2+2H+,稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质.
⑤在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是为了冲洗掉晶体表面残留的滤液,防止晶体溶解,影响产率.
(2)检验皓矾中是否含有Fe元素的操作(试剂自选)取少量皓矾溶于水配制成溶液,往所得溶液中滴加适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+.
(l)制备皓矾的实验流程如图所示.

已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
①加入的试剂①,应选用20%的H2O2,发生反应的离子方程式为2H++H2O2+2Fe2+=2Fe3++2H2O
②加入的试剂②,可选用ZnO或Zn(OH)2,其作用是调节溶液的pH至3.7-5.7,使Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质
③从晶体l→晶体2,该提纯过程的名称是重结晶.
④有同学提出,应将晶体1加入稀硫酸中溶解,请结合离子方程式解析Zn2++2H2O?Zn(OH)2+2H+,稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质.
⑤在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是为了冲洗掉晶体表面残留的滤液,防止晶体溶解,影响产率.
(2)检验皓矾中是否含有Fe元素的操作(试剂自选)取少量皓矾溶于水配制成溶液,往所得溶液中滴加适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+.
11.下列说法中,正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物物质的量的增加 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指1秒钟时某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 |
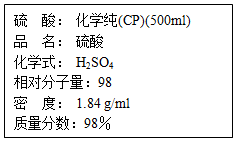 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: