题目内容
(1)写出下列有关物质的电离方程式:
①氢氟酸
②醋酸铵
③硫酸氢钠
④亚硫酸
(2)电解饱和食盐水是一项重要的化学工业,写出该反应的离子方程式是 .
①氢氟酸
②醋酸铵
③硫酸氢钠
④亚硫酸
(2)电解饱和食盐水是一项重要的化学工业,写出该反应的离子方程式是
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:(1)①氢氟酸是弱电解质不能完全电离;
②醋酸铵属于盐是强电解质,完全电离生成醋酸根离子和氨根离子;
③硫酸氢钠属于盐是强电解质,在水溶液中完全电离产生钠离子、氢离子、硫酸根离子;
④亚硫酸为弱电解质,不能完全电离,分步电离,以第一步电离为主;
(2)电解饱和食盐水生成氢氧化钠、氢气和氯气.
②醋酸铵属于盐是强电解质,完全电离生成醋酸根离子和氨根离子;
③硫酸氢钠属于盐是强电解质,在水溶液中完全电离产生钠离子、氢离子、硫酸根离子;
④亚硫酸为弱电解质,不能完全电离,分步电离,以第一步电离为主;
(2)电解饱和食盐水生成氢氧化钠、氢气和氯气.
解答:
解:(1)①氢氟酸是弱电解质,电离方程式为:HF H++F-,
H++F-,
故答案为:HF H++F-;
H++F-;
②醋酸铵属于强电解质,电离方程式为:CH3COONH4=CH3COO-+NH4+,
故答案为:CH3COONH4=CH3COO-+NH4+;
③硫酸氢钠属于盐是强电解质,在水溶液中完全电离产生钠离子、氢离子、硫酸根离子,电离方程式为:NaHSO4═Na++H++SO42-,
故答案为:NaHSO4═Na++H++SO42-;
④亚硫酸分步电离,以第一步电离为主,电离方程式为:H2SO3 H++HSO3-,
H++HSO3-,
故答案为:H2SO3 H++HSO3-;
H++HSO3-;
(2)电解饱和食盐水的离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑.
 H++F-,
H++F-,故答案为:HF
 H++F-;
H++F-;②醋酸铵属于强电解质,电离方程式为:CH3COONH4=CH3COO-+NH4+,
故答案为:CH3COONH4=CH3COO-+NH4+;
③硫酸氢钠属于盐是强电解质,在水溶液中完全电离产生钠离子、氢离子、硫酸根离子,电离方程式为:NaHSO4═Na++H++SO42-,
故答案为:NaHSO4═Na++H++SO42-;
④亚硫酸分步电离,以第一步电离为主,电离方程式为:H2SO3
 H++HSO3-,
H++HSO3-,故答案为:H2SO3
 H++HSO3-;
H++HSO3-;(2)电解饱和食盐水的离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
点评:本题考查了电离方程式的书写,题目难度不大,关键在于分清电解质的强弱,注意多元弱酸分步电离,以第一步为主.

练习册系列答案
相关题目
如图是产生和收集气体的实验装置,该装置最适合于( )
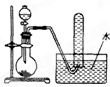

| A、用双氧水与二氧化锰反应制取O2 |
| B、用浓盐酸和MnO2反应制取Cl2 |
| C、用浓氨水和烧碱反应制取NH3 |
| D、用Na2SO3与硫酸反应制取SO2 |
25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是( )
①KNO3 ②NaOH ③CH3COONH4 ④NH4Cl.
①KNO3 ②NaOH ③CH3COONH4 ④NH4Cl.
| A、③>④>①>② |
| B、④>③>①>② |
| C、③>④>②>① |
| D、①>②>③>④ |
A元素的原子最外层(M层)有2个电子,B元素原子最外层(L层)有6个电子,则A和B形成的化合物的相对分子质量为( )
| A、56 | B、88 | C、74 | D、40 |
 ;③
;③ ;④CH3COOC2H5;⑤CH3COOH ⑥C6H6⑦C6H5CH3;⑧C2H5Br物质中:
;④CH3COOC2H5;⑤CH3COOH ⑥C6H6⑦C6H5CH3;⑧C2H5Br物质中: