题目内容
下列图象中,不能表示反应A2(g)+3B2(g)  2AB3(g)(△H<0)平衡体系的是
2AB3(g)(△H<0)平衡体系的是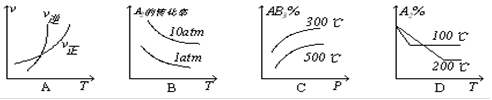
 2AB3(g)(△H<0)平衡体系的是
2AB3(g)(△H<0)平衡体系的是
D
升高温度正逆反应速率均增大,A正确。正反应是放热反应,升高温度平衡向逆反应方向移动,所以A的转化率降低,含量增加,选项D不正确。正反应是体积减小的反应,增大压强平衡向正反应方向移动,A的转化率增大,B、C正确。答案选D。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
题目内容
 2AB3(g)(△H<0)平衡体系的是
2AB3(g)(△H<0)平衡体系的是

 教材全解字词句篇系列答案
教材全解字词句篇系列答案