题目内容
12. 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
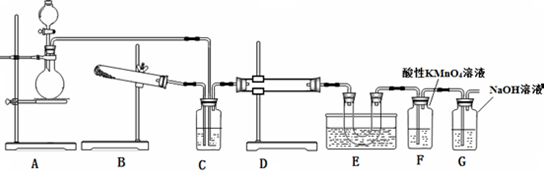
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组在实验室制备溴乙烷的装置如图.
实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应.
请问答下列问题:
(1)装置A的作用是冷凝回流
(2)反应结束后,得到的粗产品呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的b(填写上正确选项的字母).
a.饱和食盐水 b.稀氢氧化钠溶液 c.乙醇 d.四氯化碳
该实验操作中所需的主要玻璃仪器是分液漏斗(填仪器名称).
(3)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是b(填写正确选项的字母).
a.分液 b.蒸馏 c.萃取
(4)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后④①③②(按实验的操作顺序选填下列序号).
①加热 ②加入AgNO3溶液 ③加入足量稀HNO3酸化 ④加入NaOH溶液.
分析 制备溴乙烷的一种方法是乙醇与氢溴酸反应生成溴乙烷和水;
(1)长玻璃导管的作用是冷凝回流;
(2)溴单质溶解在有机物中显示棕黄色,溴单质可以和氢氧化钠发生反应;实现互不相溶液体的分离采用分液漏斗来分液;
(3)互相溶解的物质的分离采用蒸馏法;
(4)检验溴乙烷中含有溴元素一定要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验.
解答 解:制备溴乙烷的一种方法是乙醇与氢溴酸反应生成溴乙烷和水,反应的化学方程式为:CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O,
故答案为:CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O;
(1)实验时,长玻璃导管的作用是冷凝回流,可以获得要制取的有机物,故答案为:冷凝回流;
(2)溴单质溶解在有机物中显示棕黄色,为了除去粗产品中的杂质溴单质,可以用氢氧化钠来与之发生反应生成的溶液和溴乙烷互不相溶,实现溴乙烷和氯化钠、次溴酸钠水溶液的分离可以采用分液法,用分液漏斗来分液,
故答案为:a,分液漏斗;
(3)用蒸馏水洗涤,分液后,再加入无水CaCl2,溴乙烷的沸点较低,可以采用蒸馏来分离,
故答案为:b;
(4)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,是因为溴乙烷中不含有溴离子;检验溴乙烷中含有溴元素一定要将之转化为溴离子,可以采用卤代烃的水解方法,即加入氢氧化钠即可,在溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀溴化银来检验,可以加入硝酸酸化的硝酸银;
故答案为:④①③②.
点评 本题是一道考查溴乙烷的实验室制取的综合题,考查学生实验分析的能力,综合性较强,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列除去杂质所选试剂和方法均正确的是( )
| A. | 除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯 | |
| B. | 除去Fe(OH)3胶体中的NaCl:用水溶解后过滤 | |
| C. | 除去苯中的苯酚:加入浓溴水后过滤 | |
| D. | 除去溴乙烷中的溴:加入Na2S03溶液再分液 |




 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: