题目内容
【题目】金属钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,主要步骤如下:
Ⅰ.即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
Ⅱ.将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
Ⅲ.用稀盐酸溶解MgCl2和过量Mg后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:
(1)基态钛原子的价电子排布式为___。
(2)与CO互为等电子体的离子为___(填化学式)。
(3)在CH2Cl2、HCHO、CO2、C2H4中,碳原子采取sp2杂化的分子有___。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于___(填“原子”“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是___;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___。
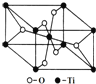
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则其中Ti4+的配位数为___。
【答案】3d24s2 CN-(或NO+、C22-) HCHO、C2H4 分子 产生白色沉淀 [Co(NH3)5SO4]Br 6
【解析】
(1)根据构造原理,由原子序数即可写出基态原子的电子排布式,进而可写出价电子排布式;
(2)根据等电子体的概念写出符合题目要求的等电子体;
(3)可根据分子的构型来判断碳的杂化方式,四面体形属于sp3杂化,平面形中的碳属于sp2杂化,直线形中的碳属于sp杂化;
(4)根据题目中提供的物理性质来判断晶体类型;
(5)络合物由内界和外界组成,络合物溶于水发生电离生成内界离子(络离子)和外界离子,与BaCl2或AgNO3溶液反应的离子肯定为外界离子,由此可判断络合物的组成;
(6)观察晶胞,Ti周围距离最近的O的个数即为Ti的配位数。
![]() 钛为22号元素,基态电子排布式为:
钛为22号元素,基态电子排布式为:![]() ,则基态钛原子的价电子排布式为
,则基态钛原子的价电子排布式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 为双原子分子,价电子总数为10,则CO的等电子体为离子的为:CN-(或NO+、C22-),故答案为:CN-(或NO+、C22-);
为双原子分子,价电子总数为10,则CO的等电子体为离子的为:CN-(或NO+、C22-),故答案为:CN-(或NO+、C22-);
![]() 在
在![]() 中,分子构型分别为四面体形、平面三角形、直线形、平面形,所以碳原子的杂化方式分别为
中,分子构型分别为四面体形、平面三角形、直线形、平面形,所以碳原子的杂化方式分别为![]() 、
、![]() 、sp、
、sp、![]() 杂化,采取
杂化,采取![]() 杂化的分子有HCHO、
杂化的分子有HCHO、![]() ,故答案为:HCHO、
,故答案为:HCHO、![]() ;
;
![]() 因
因![]() 在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断
在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断![]() 是由共价键结合的分子,晶体类型属于分子晶体.故答案为:分子;
是由共价键结合的分子,晶体类型属于分子晶体.故答案为:分子;
![]() 由
由![]() 可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀.加入
可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀.加入![]() 溶液时,无明显现象,说明硫酸根离子在内界,若加入
溶液时,无明显现象,说明硫酸根离子在内界,若加入![]() 溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为
溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为![]()
![]() .故答案为:产生白色沉淀;
.故答案为:产生白色沉淀;![]()
![]() ;
;
![]() 观察晶胞结构,可知每个钛周围距离最近的氧原子有6个,即钛的配位数为6,故答案为:6。
观察晶胞结构,可知每个钛周围距离最近的氧原子有6个,即钛的配位数为6,故答案为:6。

 阅读快车系列答案
阅读快车系列答案【题目】莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 | AgCl | AgBr | Ag2CrO4 |
颜色 | 白 | 浅黄 | 砖红 |
滴定终点的现象是______,终点现象对应的离子反应方程式为______。为了测定产品中(NH4)2Cr2O7的含量,称取样品0.1500g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为______。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/mol)。