题目内容
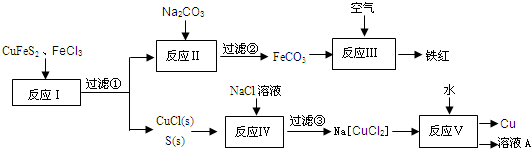
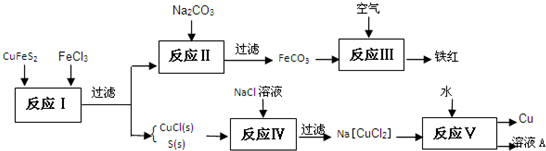
以黄铜矿为主要原料来生产铜、铁红颜料和硫单质,原料的综合利用率较高.其主要流程如下:

(1)滤③得到的滤渣成分是:______.(填化学式)
(2)应Ⅰ~Ⅴ中,共有______个反应不属于氧化还原反应.
(3)溶液A中含有的溶质是______.(填化学式)
(4)出反应Ⅰ的化学方程式:______.
(5)反应Ⅲ是FeCO3在空气中煅烧,写出化学方程式:______.
解:(1)在氯化亚铜和单质硫的混合物中,加入氯化钠的溶液,则氯化亚铜会和氯化钠反应而溶解,而硫难溶于水,过滤,得到滤渣为S,故答案为:S;
(2)在反应中,碳钠和FeCl3之间发生的是复分解反应,氯化亚铜和氯化钠的反应不是氧化还原反应,故答案为:2;
(3)反应Ⅴ为Na[CuCl2]和H2O之间的反应,生成物是Cu、NaCl和CuCl2,所得的溶液中的溶质是CuCl2、NaCl,故答案为:CuCl2、NaCl;
(4)CuFeS2和3FeCl3之间发生的是氧化还原反应,化学方程式为:CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓,
故答案为:CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓;
(5)FeCO3在空气中煅烧会和氧气发生反应4FeCO3+O2 4CO2+2Fe2O3,故答案为:4FeCO3+O2
4CO2+2Fe2O3,故答案为:4FeCO3+O2 4CO2+2Fe2O3.
4CO2+2Fe2O3.
分析:(1)硫难溶于水,微溶于酒精,易溶于二硫化碳;
(2)有元素化合价变化的反应是氧化还原反应;
(3)根据反应Ⅴ的发生情况来确定最终的产物;
(4)CuFeS2和3FeCl3之间发生的是氧化还原反应,根据化学方程式的写法来书写;
(5)FeCO3在空气中煅烧会和氧气发生反应.
点评:本题考查学生金属铜以及化合物之间的性质,考查学生分析和解决问题的能力,综合性较强,难度大.
(2)在反应中,碳钠和FeCl3之间发生的是复分解反应,氯化亚铜和氯化钠的反应不是氧化还原反应,故答案为:2;
(3)反应Ⅴ为Na[CuCl2]和H2O之间的反应,生成物是Cu、NaCl和CuCl2,所得的溶液中的溶质是CuCl2、NaCl,故答案为:CuCl2、NaCl;
(4)CuFeS2和3FeCl3之间发生的是氧化还原反应,化学方程式为:CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓,
故答案为:CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓;
(5)FeCO3在空气中煅烧会和氧气发生反应4FeCO3+O2
 4CO2+2Fe2O3,故答案为:4FeCO3+O2
4CO2+2Fe2O3,故答案为:4FeCO3+O2 4CO2+2Fe2O3.
4CO2+2Fe2O3.分析:(1)硫难溶于水,微溶于酒精,易溶于二硫化碳;
(2)有元素化合价变化的反应是氧化还原反应;
(3)根据反应Ⅴ的发生情况来确定最终的产物;
(4)CuFeS2和3FeCl3之间发生的是氧化还原反应,根据化学方程式的写法来书写;
(5)FeCO3在空气中煅烧会和氧气发生反应.
点评:本题考查学生金属铜以及化合物之间的性质,考查学生分析和解决问题的能力,综合性较强,难度大.

练习册系列答案
相关题目