题目内容
【题目】两种常见的非金属元素A与B,与常见的三种金属元素C、D、E,A的一种单质是自然界硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸,也能与NaOH溶液反应生成![]() ,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
![]() 物质X的名称______。
物质X的名称______。
![]() 将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因______。
将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因______。
![]() 写出E的单质与水蒸气反应的化学方程式______。
写出E的单质与水蒸气反应的化学方程式______。
![]() gC的单质投入足量
gC的单质投入足量![]() 溶液中,下列实验现象正确的有______。
溶液中,下列实验现象正确的有______。
A.钠沉在溶液底部
B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音
D.生成红色固体物质
![]() 第
第![]() 中可能的离子方程式为______。将所得沉淀过滤、洗涤、干燥,可得到______g固体。
中可能的离子方程式为______。将所得沉淀过滤、洗涤、干燥,可得到______g固体。
![]() 在少量
在少量![]() 中燃烧,所得混合气体在标况下的平均摩尔质量为
中燃烧,所得混合气体在标况下的平均摩尔质量为![]() ,则A与
,则A与![]() 的物质的量之比为______。
的物质的量之比为______。
【答案】过氧化钠 ![]() 熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落
熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落 ![]()
![]()
![]()
![]()
![]()
![]()
![]() :5
:5
【解析】
A的一种单质是自然界硬度最大的物质,应为金刚石,则A为C元素,B与C的单质在加热条件下反应生成淡黄色化合物X,X为![]() ,D的单质既能与盐酸,也能与NaOH溶液反应生成
,D的单质既能与盐酸,也能与NaOH溶液反应生成![]() ,D为Al,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y,可知E为Fe,B为O,Y为
,D为Al,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y,可知E为Fe,B为O,Y为![]() ,则可知C为Na,以此解答该题。
,则可知C为Na,以此解答该题。
![]() 由以上分析可知X为过氧化钠;
由以上分析可知X为过氧化钠;
![]() 在加热条件下与氧气反应生成氧化铝,氧化铝的熔点比铝高,所以熔化的铝被氧化铝兜着,并不滴落;
在加热条件下与氧气反应生成氧化铝,氧化铝的熔点比铝高,所以熔化的铝被氧化铝兜着,并不滴落;
![]() 为Fe,在高温下与水蒸气反应,方程式为
为Fe,在高温下与水蒸气反应,方程式为![]()
![]()
![]() ;
;
![]() 为Na,可与水剧烈反应生成氢氧化钠和氢气,则加入到硫酸铜溶液中生成氢氧化铜和氢气,反应放出热量,钠熔化,且浮在水面上,故答案为:BC;
为Na,可与水剧烈反应生成氢氧化钠和氢气,则加入到硫酸铜溶液中生成氢氧化铜和氢气,反应放出热量,钠熔化,且浮在水面上,故答案为:BC;
![]() 反应的相关离子方程式为
反应的相关离子方程式为![]() ,依据反应的定量关系,ag钠物质的量
,依据反应的定量关系,ag钠物质的量![]() ,将所得沉淀过滤、洗涤、干燥,得到
,将所得沉淀过滤、洗涤、干燥,得到![]() ,依据反应定量关系得到,
,依据反应定量关系得到,![]() ,固体质量
,固体质量![]() ;
;
![]() 碳在少量氧气中燃烧,可生成CO和
碳在少量氧气中燃烧,可生成CO和![]() ,所得混合气体在标况下的平均摩尔质量为
,所得混合气体在标况下的平均摩尔质量为![]() ,可设生成COxmol,
,可设生成COxmol,![]() ,则
,则![]() ,x:
,x:![]() :1,则n(C):
:1,则n(C):![]() :
:![]() :5。
:5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
时间(s) | 0 | 2 | 4 |
c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
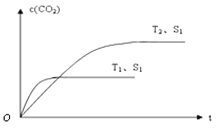
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是
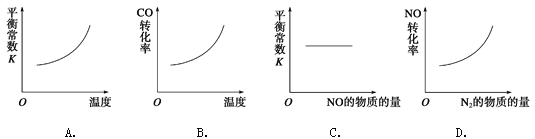
【题目】根据表中信息,判断下列叙述中正确的是
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | Cl﹣ | ||
② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
③ | KClO3 | 浓盐酸 | Cl2 |
A.表中①组反应可能有一种或两种元素被氧化
B.表中②组反应的离子方程式是2 MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O
C.表中③组反应的还原产物是KCl,电子转移数目是6e﹣
D.氧化性强弱比较:KClO3>Fe3+>Cl2>Br2