题目内容
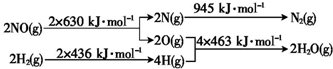
9.氨气是一种重要的化工产品及工业原料.I.一定条件下,将1molN2(g)和3molH2(g)投入某密闭容器中,当反应物的转化率为50%时,反应放出46.2kJ的热量.
(1)写出合成氨的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
(2)某温度下,反应N2(g)+3H2(g)?2NH3(g)的平衡常数K=3.0×104,如果在体积恒定为1L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3,则反应逆向进行 (填“正向进行”、“逆向进行”或“达到平衡”).
(3)该温度下,在体积恒定为1L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是C.
A.1molN2、3molH2和2molNH3
B.1molN2和3molH2
C.2molN2和6molH2
D.1molN2和2.8molH2
Ⅱ.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)室温下,向完全相同的三份(NH4)2SO4水溶液中分别加入少量的①Na2CO3固体 ②FeCl3固体 ③KCl固体,所得溶液中NH${\;}_{4}^{+}$的浓度由大到小的顺序是②③①(用编号表示)
(5)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成的沉淀是Cu(OH)2,生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.(室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
分析 (1)转化50%放出热量为46.2kJ,那么100%转化应放出热量为46.2kJ×2=92.4kJ,据此书写即可;
(2)根据浓度积与平衡常数K的关系比较判断反应进行的方向;
(3)依据加入一种反应物可以增加另外一种反应物的转化率回答;
(4)含有弱根离子的盐溶液,如果两种溶液的酸碱性相同,那么它们混合后会相互抑制水解;如果一种溶液显酸性,另一种溶液显碱性,那么它们混合后弱根离子能相互促进水解,据此判断即可;
(5)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,据此解答即可.
解答 解:Ⅰ.(1)依据题意:将1molN2(g)和3molH2(g)投入某密闭容器中,当反应物的转化率为50%时,反应放出46.2kJ的热量,故完全反应放出热量为92.4kJ,故合成氨的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
(2)合成氨反应浓度积=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.{2}^{2}}{0.01×0.0{1}^{3}}$=40000=4×104>K=3.0×103,所以平衡应向逆反应方向移动,故答案为:逆反应;
(3)A与B相比,A中含有大量的氨气,因此B中氨气的转化率大于A中.B与D相比,B中氢气浓度大,氮气转化率高;由于正方应是体积减小的可逆反应,所以增大压强平衡向正反应方向进行,C与B相比,相当于是在B的基础上增大压强,氮气转化率增大,据此得出氮气转化率最大的是C,故答案为:C;
Ⅱ.(4)(NH4)2SO4是强酸弱碱盐水解呈酸性,①Na2CO3是强碱弱酸盐,溶于水显碱性,促进铵根的水解,故铵根浓度减小;
②FeCl3是强酸弱碱盐,溶于水显酸性,抑制铵根离子水解,铵根浓度增大;
③KCl是强酸强碱盐,不水解,故铵根浓度不变,据此得出铵根浓度最大的是②,最小的是①,故答案为:②③①;
(5)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
点评 本题考查较为综合,涉及化学平衡状态的判断、盐类水解、水的电离等知识,为高考常见题型,难度中等,注意把握相关基本理论的理解和应用.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案| A. | 无色溶液:SO42-、Cl-、Mg2+、NH4+ | |
| B. | 含有较多Ag+溶液:SO42-、K+、Na+、OH- | |
| C. | 能使石蕊试纸变红色的溶液:K+、SO32-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液:Na+、SO42-、AlO2-、K+ |
| A. | NaHSO4的电离:NaHSO4=Na++H++SO${\;}_{4}^{2-}$ | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
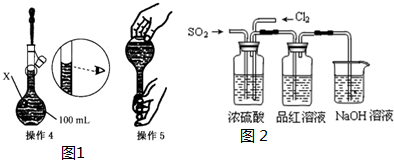
| C. | S2-的结构示意图: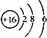 | |
| D. | 质子数为94,中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 | |
| B. | 向盐酸中滴加氨水:H++OH-=H2O | |
| C. | 向KI溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4 2-=CaSO4↓+H2O |
| A. | XYZ2 | B. | X2YZ3 | C. | X2YZ2 | D. | XYZ3 |
| 操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解. 操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中. 操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处. |
①仪器X的名称是100mL容量瓶.
②关于该配制过程,下列说法正确的是AB.
A.操作1中,应称取胆矾晶体的质量为2.5g
B.操作2中,洗涤液需要转移到仪器X中
C.操作4称为定容,由于该同学观察方法不正确,将导致所配溶液浓度偏高
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)甲、乙同学用下图装置验证SO2和Cl2的漂白性:甲同学按1:1通气时,品红溶液几乎不褪色,品红溶液不褪色的原因是(用方程式表示):SO2+Cl2+2H2O=SO42-+2Cl-+4H+;而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,乙同学做到让品红溶液变得越来越浅的原因是增加二氧化硫的通入量或增加氯气通入量.
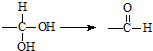 .有机物
.有机物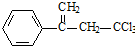 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质既有对映异构,也有顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.