题目内容
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
【答案】B
【解析】
A、依据反应过程和溶液中存在的电荷守恒分析判断;
B、常温时,某溶液中由水电离出的![]()
![]() ,若
,若![]() 时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
C、碱的强弱不知,若为强酸、强碱混合,呈中性,若为强酸、弱碱混合,则相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合显碱性;
一元碱BOH溶液混合显碱性;
D、HClO是弱酸,所以NaClO溶液中发生水解反应:![]() ,使溶液呈碱性,氢离子浓度小于
,使溶液呈碱性,氢离子浓度小于![]() ,所以NaCl溶液中
,所以NaCl溶液中![]() 大于NaClO溶液中
大于NaClO溶液中![]() ,依据电荷守恒分析。
,依据电荷守恒分析。
A、将![]() 通入
通入![]()
![]() 溶液中恰好呈中性,溶液中存在电荷守恒,
溶液中恰好呈中性,溶液中存在电荷守恒,![]() ,
,![]() ,则得到
,则得到![]() ,故A正确;
,故A正确;
B.常温时,某溶液中由水电离出的![]()
![]() ,若
,若![]() 时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则
时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则![]() ,如为碱溶液,则
,如为碱溶液,则![]() ,故B错误;
,故B错误;
C、![]() 硫酸,
硫酸,![]() ,硫酸完全电离,
,硫酸完全电离,![]() 一元碱BOH,
一元碱BOH,![]() ,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故C正确;
,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故C正确;
D、HClO是弱酸,所以NaClO溶液中发生水解反应:![]() ,使溶液呈碱性,氢离子浓度小于
,使溶液呈碱性,氢离子浓度小于![]() ,所以NaCl溶液中
,所以NaCl溶液中![]() 大于NaClO溶液中
大于NaClO溶液中![]() ,根据电荷守恒:
,根据电荷守恒:![]() 可得溶液中离子总数为
可得溶液中离子总数为![]() ;同理可得NaClO溶液中总数为
;同理可得NaClO溶液中总数为![]() ,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
故选:B。

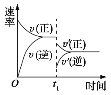
【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,恒容密闭容器中发生反应Ni(s)+4CO(g)![]() Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A.25℃达到平衡时,向容器中继续充入CO(g),CO的转化率减小
B.温度越低,越有利于Ni(CO)4的生产
C.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正<v逆
D.平衡后,向密闭容器中加入少量镍粉,平衡正向移动,达到新平衡时CO的浓度比原平衡小