题目内容
某溶液中可能含有Mg2+、Al3+、SO42-、I-,分别取样进行如下实验:
①加入氯水时,溶液呈黄色,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀;
②加入过量的NaOH溶液,产生白色沉淀.
则下列离子中不能确定其是否存在的是
- A.Mg2+
- B.Al3+
- C.SO42-
- D.I-
B
分析:①加入氯水时,溶液呈黄色,证明有单质碘出现,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,可以是硫酸钡沉淀;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁,证明含有镁离子.
解答:①加入氯水时,溶液呈黄色,证明含有碘离子,碘离子被氯气氧化为碘单质,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,只能是硫酸钡沉淀,证明含有硫酸根离子;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁沉淀,一定会含有镁离子,可能含有铝离子,因为生成的氢氧化铝可以溶于过量的氢氧化钠中.
所以离子中不能确定其是否存在的是铝离子.
故选B.
点评:本题主要考查了根据实验现象判断离子共存,要掌握根据实验现象判断存在的离子,排除与该离子反应的离子.
分析:①加入氯水时,溶液呈黄色,证明有单质碘出现,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,可以是硫酸钡沉淀;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁,证明含有镁离子.
解答:①加入氯水时,溶液呈黄色,证明含有碘离子,碘离子被氯气氧化为碘单质,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,只能是硫酸钡沉淀,证明含有硫酸根离子;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁沉淀,一定会含有镁离子,可能含有铝离子,因为生成的氢氧化铝可以溶于过量的氢氧化钠中.
所以离子中不能确定其是否存在的是铝离子.
故选B.
点评:本题主要考查了根据实验现象判断离子共存,要掌握根据实验现象判断存在的离子,排除与该离子反应的离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
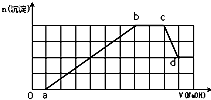 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 | B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |


