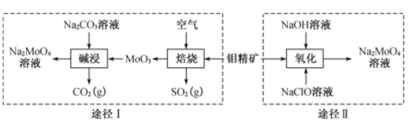
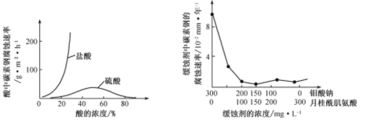
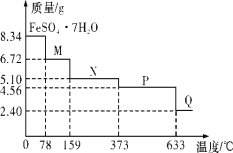
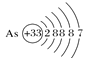
题目内容
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。
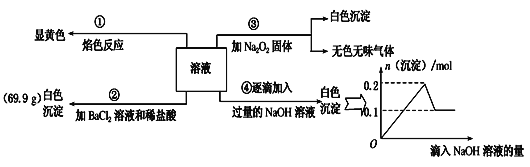
请回答下列问题:
(1)焰色反应是___(填“物理”或“化学”)变化;实验③中产生的无色无味气体是___(填化学式)。
(2)原溶液中一定存在的离子有___;一定不存在的离子有___。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=___mol/L。
【答案】物理 O2 Na+、Mg2+、Al3+、SO42- Fe3+、Cu2+、CO32-、NH4+ 0.6
【解析】
溶液为无色,说明不存在Fe3+和Cu2+,①经过焰色反应显黄色,说明存在Na+,②加入BaCl2和稀盐酸产生白色沉淀,说明一定存在SO42-,可能存在CO32-,③加入Na2O2固体,Na2O2与水反应生成NaOH和O2,无色无味的气体是O2,说明没有NH4+,产生白色沉淀,说明存在Mg2+、Al3+中的一种或两种,④逐滴加入NaOH溶液直至过量,沉淀的总物质的量先是增大到最大值,后又减少直至不变,说明一定存在Al3+和Mg2+,则不存在CO32-,据此分析解答。
(1)焰色反应中没有新物质生成,是物理变化;实验③中加入Na2O2固体,Na2O2与水反应生成NaOH和O2,无色无味的气体是O2,故答案为:物理;O2;
(2)根据以上分析可知,原溶液中一定存在的离子有:Na+、Mg2+、Al3+、SO42-,
一定不存在的离子有:Fe3+、Cu2+、CO32-、NH4+,而K+则无法判断,故答案为:Na+、Mg2+、Al3+、SO42-;Fe3+、Cu2+、CO32-、NH4+;
(3)第②步产生的是BaSO4沉淀,则n(SO42-)=![]() =0.3mol,第④步中,沉淀产生最大物质的量为0.2mol,说明n(Al3+)+n(Mg2+)=0.2mol,最后剩下0.1mol沉淀,说明n(Mg2+)=0.1mol,则n(Al3+)=0.1mol,根据溶液为电中性,则有2n(Mg2+)+3n(Al3+)+n(Na+)+n(K+)=2n(SO42-),即2×0.1mol+3×0.1mol+n(Na+)+1×0.04mol=2×0.3mol,所以c(Na+)=
=0.3mol,第④步中,沉淀产生最大物质的量为0.2mol,说明n(Al3+)+n(Mg2+)=0.2mol,最后剩下0.1mol沉淀,说明n(Mg2+)=0.1mol,则n(Al3+)=0.1mol,根据溶液为电中性,则有2n(Mg2+)+3n(Al3+)+n(Na+)+n(K+)=2n(SO42-),即2×0.1mol+3×0.1mol+n(Na+)+1×0.04mol=2×0.3mol,所以c(Na+)=![]() =0.6mol/L,故答案为:0.6。
=0.6mol/L,故答案为:0.6。