题目内容
已知298 K、101 kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变为O3为放热反应
B.O3比O2稳定,由O2变为O3为吸热反应
C.O2比O3稳定,由O2变为O3为放热反应
D.等质量的O2比O3能量低,由O2变为O3为吸热反应
【答案】
D
【解析】
试题分析:已知25℃、101kpa条件下:
(1)4Al(s)+302(g)═2Al2O3(s);△H=-2834.9kJ·mol-1
(2)4Al(s)+2O3(g)═2Al2O3(s);△H=-3119.1KJ·mol-1
根据盖斯定律(1)-(2)得到:3O2(g)═2O3(g)△H=-2834.9kJ·mol-1-(-3119.1KJ·mol-1)=284.1KJ·mol-1。A.氧气转化为臭氧是吸热反应,3mol氧气生成2mol臭氧吸收的热量284.2kJ,A错误;B.等质量的O2比O3的能量低,所以O2比O3稳定,B错误;C.由O2变为O3的化学反应为吸热反应,C错误;D.等质量的O2比O3能量低,由O2变为O3为吸热反应,D正确;选D.
考点:化学能与热能的相互转化;反应热和焓变

练习册系列答案
相关题目

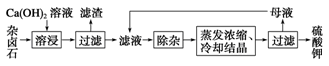
 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: