题目内容
【题目】下列操作或试剂选择合理的是
A.可用蒸发结晶、趁热过滤的方法提纯含少量![]() 杂质的NaCl
杂质的NaCl
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含![]()
C.某碱性水样滴加稀盐酸无沉淀,再加![]() 溶液,出现白色沉淀,则原水样中一定含
溶液,出现白色沉淀,则原水样中一定含![]()
D.可用酸性![]() 溶液检验
溶液检验![]() 溶液中是否含有
溶液中是否含有![]()
【答案】A
【解析】
A. 硝酸钾溶解度随温度升高急剧增大,但氯化钠的溶解度受温度影响较小,将混合物配成饱和溶液,然后加热蒸发水,这样首先析出的是氯化钠,少量的硝酸钾仍残留在热的溶液中,所以此法可以,故A正确;
B. 加水溶解过程中,![]() 可能被氧化为
可能被氧化为![]() ,所以原固体中不一定含
,所以原固体中不一定含![]() ,故B错误;
,故B错误;
C. 因为原溶液为碱性,所以滴加盐酸时并不一定呈酸性,再加![]() 溶液,出现白色沉淀,可能为碳酸钡沉淀,则原水样中不一定含
溶液,出现白色沉淀,可能为碳酸钡沉淀,则原水样中不一定含![]() ,故C错误;
,故C错误;
D. 酸性高锰酸钾可氧化氯离子,所以不能用酸性![]() 溶液检验
溶液检验![]() 溶液中是否含有
溶液中是否含有![]() ,故D错误。
,故D错误。
故选A。

 阳光课堂同步练习系列答案
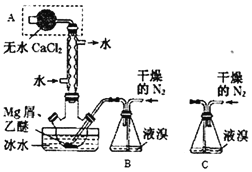
阳光课堂同步练习系列答案【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
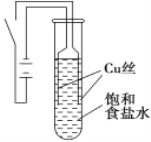
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜 | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C.从实验看出氢氧化亚铜具有不稳定性
D.试管底部红色的固体具有还原性
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
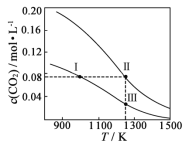
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。