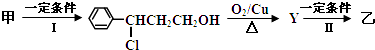题目内容
【题目】某溶液中大量存在以下五种离子NO ![]() 、SO
、SO ![]() 、Al3+、H+、M.其物质的量浓度之比为c(NO
、Al3+、H+、M.其物质的量浓度之比为c(NO ![]() ):c(SO
):c(SO ![]() ):c(Al3+):c(H+):c(M)=4:3:1:3:2,则M可能是( )
):c(Al3+):c(H+):c(M)=4:3:1:3:2,则M可能是( )
A.Fe2+
B.Cl﹣
C.Mg2+
D.Ba2+
【答案】C
【解析】解:由于Ba2+与SO ![]() 反应生成BaSO4沉淀,则M不可能为Ba2+ , 酸性条件下NO
反应生成BaSO4沉淀,则M不可能为Ba2+ , 酸性条件下NO ![]() 可以氧化Fe2+ , 则M也不可能为Fe2+ , 设c(NO
可以氧化Fe2+ , 则M也不可能为Fe2+ , 设c(NO ![]() )、c(SO
)、c(SO ![]() )、c(Al3+)、c(H+)、c(M)分别为4mol/L、3mol/L、1mol/L、3mol/L、2mol/L,由电荷守恒可知:3c(Al3+)+c(H+)=6mol/L<c(NO
)、c(Al3+)、c(H+)、c(M)分别为4mol/L、3mol/L、1mol/L、3mol/L、2mol/L,由电荷守恒可知:3c(Al3+)+c(H+)=6mol/L<c(NO ![]() )+2c(SO
)+2c(SO ![]() )=10mol/L,故M为阳离子,且M所得电荷数为
)=10mol/L,故M为阳离子,且M所得电荷数为 ![]() =2,故选项中Mg2+符合,
=2,故选项中Mg2+符合,
故选:C.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目