题目内容
【题目】T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
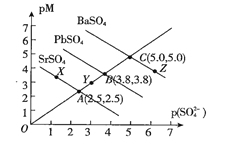
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为102.4
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
【答案】D
【解析】
A.硫酸根离子浓度和铅离子浓度乘积达到或大于PbSO4沉淀溶度积常数可以沉淀,一定条件下BaSO4可以转化成PbSO4,故A错误;
B.Z点对应的溶液为饱和溶液,溶液中钡离子浓度和硫酸根离子浓度乘积为常数,pM=-lgc(M),p(SO42-)=-lgc(SO42-),则c(Ba2+)>c(SO42-),同理X点饱和溶液中c(Sr2+)<c(SO42-),故B错误;
C.图象分析可知溶度积常数SrSO4、PbSO4、BaSO4分别为10-2.5×10-2.5、10-3.8×10-3.8、10-5×10-5,因此溶度积常数:BaSO4<PbSO4<SrSO4,因此在ToC时,用0.01mol·L-1Na2SO4溶液滴定20mL浓度均是0.01mol·L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Ba2+先沉淀,故C错误;
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为
BaSO4(s)+Pb2+(aq)的平衡常数为![]() =102.4,故D正确;
=102.4,故D正确;
答案选D。

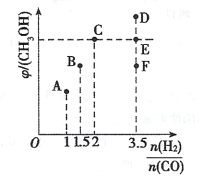
【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)==CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)==CO2(g)+H2(g) △H2=-41.2kJ/mol
T1°C时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
请回答下列问题:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=_____
(2)30s时CH4的转化率为_______,20~40s,v(H2)=_______.
(3)T2°C时,该反应的化学平衡常数为1.5,则T2___T1(填“>”“=”或 “<”。)
(4)T1°C时反应③达到平衡的标志为______________。
A.容器内气体密度不变 B.体系压强恒定
C.CO和H2的体积分数相等且保持不变 D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后/span>,其他条件不变,在70 s时再加入2 molCH4和1molCO2,此刻平衡的移动方向为________(填“不移动”“正向”或“逆向"),重新达到平衡后,CO2的总转化率比原平衡____________(填“大”“小”或“相等”)。