题目内容
|
在合成氨工业中,除了采用高压、加入催化剂外,还把温度提高到500℃左右,其原因和目的是 | |
| [ ] | |
A. |
提高氮气的转化率 |
B. |
提高氨气平衡时的质量分数 |
C. |
催化剂的活性温度为500℃ |
D. |
升高温度, |
答案:C
解析:
解析:
|
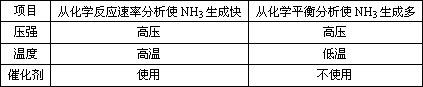
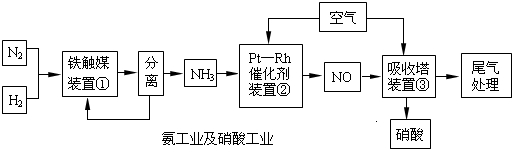
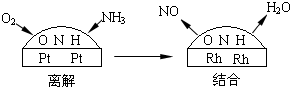
精析:合成氨的反应为N2(g)+3H2(g) 由于正反应是放热反应,从化学平衡移动的原理分析可知,升高温度,平衡向逆反应方向移动,氨气的转化率和氨气平衡时的质量分数都是变小的.所以A、B项均错.温度升高, 小结:合成氨的反应为N2(g)+3H2(g) 反应有三个特点:可逆反应,正反应是放热反应,正反应是体积缩小的反应.为了提高NH3的产量,可以从化学反应速率和化学平衡原理两方面分析:
从上表可知,在实际生产中,选择合成氨的适宜条件为:①从动力、材料和设备这三方面考虑,通常采用2×107~5×107 Pa的压强,而不采取尽可能高的压强;②从达到平衡所需的时间和催化剂活性温度考虑,一般选择500℃左右的温度;③从加大氮气和氢气合成氨的反应速率考虑,要使用催化剂. |

练习册系列答案
相关题目
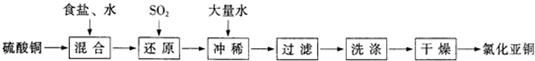
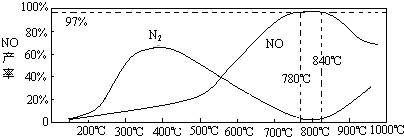
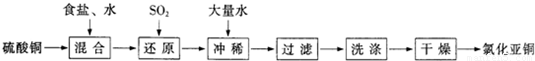
 CuCl↓+Cl-.
CuCl↓+Cl-.