题目内容
1.每年的6月26日是国际禁毒日.如图所示是四种毒品的结构简式,下列有关说法正确的是( )
| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | 摇头丸经消去、加成反应可制得冰毒 | |
| C. | 1mol大麻与溴水反应最多消耗4mol Br2 | |
| D. | 氯胺酮分子中环上所有碳原子可能共平面 |
分析 A.均含至少3种元素,而烃只含C、H元素;
B.摇头丸制得冰毒,先发生-OH的消去反应,再与氢气加成;
C.大麻中酚-OH的2个邻位与双键与溴水反应;
D.氯胺酮分子中,苯环上C原子共面,但环己酮结构中含5个四面体构型的C原子.
解答 解:A.均含至少3种元素,而烃只含C、H元素,则均不属于芳香烃,故A错误;
B.摇头丸制得冰毒,先发生-OH的消去反应,再与氢气加成,反应类型分别为消去反应、加成反应,故B正确;
C.大麻中酚-OH的2个邻位与双键与溴水反应,则1mol大麻与溴水反应最多消耗3mol Br2,故C错误;
D.氯胺酮分子中,苯环上C原子共面,但环己酮结构中含5个四面体构型的C原子,则环己酮结构中C原子不可能共面,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃、醇的性质及迁移应用能力的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
9.下列叙述错误的是( )
| A. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| B. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |
9.“Cl化学”是指以碳单质或分子中含有1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的工艺,对开发新能源和控制环境污染有重要意义.

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
请回答:①c1=c2(填“>”“<”或“=”),a=19.6
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)
16.下列说法错误的是( )
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相对分子质量相等的两种物质,不一定是同分异构体 | |
| D. | 在常温常压下,C4H10是气体 |
10.下列各组中的性质比较中,正确的有( )
| A. | 酸性 HClO4>HBrO4>HIO4 | B. | 碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 非金属性 F>Cl>Br | D. | 稳定性 HCl>H2S>PH3 |
11.下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4)/mol•L-1 | v(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体反应物的表面积对反应速率有影响.
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填实验序号).
(3)其实验6和其实验7表明温度对反应速率有影响.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:可能是硫酸过量,等质量的金属完全反应,放出的热量相等,所以使等体积溶液的温度升高值相近.

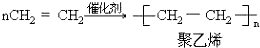 ;反应类型加聚反应.
;反应类型加聚反应.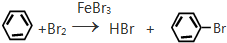 ;反应类型取代反应.
;反应类型取代反应.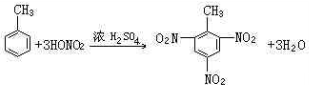 ;反应类型硝化反应(取代反应).
;反应类型硝化反应(取代反应).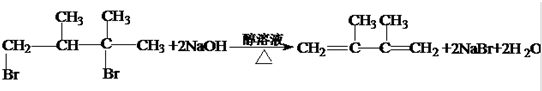 ;反应类型消去反应.
;反应类型消去反应.