题目内容
1.下列说法中正确的是( )| A. | 已知BF3键角为120°,则SnBr2键角小于120° | |
| B. | SO2是直线型分子 | |
| C. | PCl5是三角锥形分子 | |
| D. | 四氨合铜离子中铜离子的配位数为2 |
分析 A.BF3分子中B原子价层电子对个数是3且不含孤电子对,所以该分子空间构型是平面三角形;SnBr2分子中Sn价层电子对个数是3且含有一个孤电子对,为V形结构,且孤电子对和共价键之间的排斥力大于共价键之间排斥力;
B.二氧化硫分子中S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3且含有一个孤电子对,根据价层电子对互斥理论判断空间构型;
C.五氯化磷分子中P原子价层电子对个数=5+$\frac{1}{2}$×(5-5×1)=5,为三角双锥结构;
D.四氨合铜离子为Cu(NH3)4]2+,配位数是4.
解答 解:A.BF3分子中B原子价层电子对个数是3且不含孤电子对,所以该分子空间构型是平面三角形,键角为120°;SnBr2分子中Sn价层电子对个数是3且含有一个孤电子对,为V形结构,且孤电子对和共价键之间的排斥力大于共价键之间排斥力,所以键角小于120°,故A正确;
B.二氧化硫分子中S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3且含有一个孤电子对,根据价层电子对互斥理论知空间构型为V形,故B错误;
C.五氯化磷分子中P原子价层电子对个数=5+$\frac{1}{2}$×(5-5×1)=5,为三角双锥结构,其中三个Cl原子和P原子位于同一平面上,另外两个Cl原子位于三角双锥顶点上,故C错误;
D.四氨合铜离子为Cu(NH3)4]2+,配位数是4,故D错误;
故选A.
点评 本题考查键角、微粒空间构型判断、配位数判断等知识点,为高频考点,利用价层电子对互斥理论分析解答即可,难点是价层电子对个数的计算,注意C中分子空间构型特点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列各组离子中,能在强酸性溶液中大量共存的是( )
| A. | K+、Cu2+、SO42-、Cl- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Na+、K+、NO3-、HCO3- | D. | Na+、NH4+、OH-、SO42- |
16.Ag2CrO4是一种橙红色固体,t℃时,其在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )


| A. | 在t℃时,饱和Ag2CrO4溶液中,若增大c(CrO42-),则银离子浓度增大 | |
| B. | 在t℃时,Ag2CrO4的Ksp为1×10-12 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,Y、Z两点处Ag2CrO4的溶度积常数前者大 |
6.以下四种有机物的分子式皆为C4H10O:其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
① ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③ ④
④
①
 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③ ④
④
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
13.下列物质中,化学键类型相同的一组是( )
| A. | NaCl、HCl | B. | MgCl2、SO2 | C. | KCl、CCl4 | D. | CO2、H2O |
10.某元素最高价含氧酸的化学式是HRO3,该元素的气态氢化物化学式可表示为( )
| A. | HR | B. | H2R | C. | RH3 | D. | 不能确定 |
11.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的质量增加了8.1g,则此反应的反应速率v(X)可表示为( )
| A. | v(NH3)=0.010 mol/( L•s) | B. | v(O2)=0.001 mol/( L•s) | ||
| C. | v(NO)=0.001 mol/( L•s) | D. | v(H2O)=0.045 mol/( L•s) |
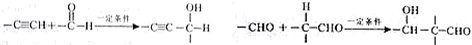

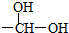 极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).
极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).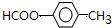 (写出结构简式).
(写出结构简式).