题目内容
将3.20 g Cu跟30.0 mL 10 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
A.(0.1+a)mol B.2a mol C.0.1a mol D.0.5a mol
A
【解析】
试题分析:反应后溶液中有amol的氢离子,就有amol的硝酸,3.2g铜的物质的量为0.05mol,反应后生成硝酸铜的物质的量为0.05mol,有0.1mol的硝酸根离子,故硝酸根的总物质的量为(0.1+a)mol。
考点:考查铜与硝酸的反应和原子守恒的应用。

练习册系列答案
相关题目
下列实验操作完全正确的是
编号 | 实验 | 操作 |
A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
B | 实验室制备氢氧化铝 | 向盛有硫酸铝溶液的试管中逐滴滴加氢氧化钠至过量 |
C | 检验溶液中的Fe3+ | 向溶液中滴加几滴硫氰化钾溶液 |
D | 实验室制备氢氧化亚铁沉淀 | 向盛有硫酸亚铁溶液的试管中逐滴加入氢氧化钠溶液,并边滴加边振荡 |
 B.
B. C.
C.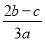 D.
D.
 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断

